名校
1 . A、B、D、E、M、X、Y、Z是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;B的基态原子次外层有2个电子,最外层有3个未成对电子;D原子的2p轨道上有1个电子的自旋方向与其它电子相反;E的价层电子排布式为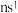 ;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
(1)D、E、M分别形成的简单离子的半径由大到小顺序为(填离子符号)___________ 。
(2)元素B基态原子的核外电子排布式为___________ ,电子的空间运动状态有___________ 种,它与同周期相邻的两种元素中的第一电离由大到小的顺序是___________ (写元素符号)。
(3)Z与D形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为___________ ;
②D的配位数是___________ ;
③D周围最近的D有___________ 个;
④距离Z最近D的为___________ 个;
⑤此晶体的密度为___________  ;(已知晶胞参数为anm)
;(已知晶胞参数为anm)
⑥此化合物先加稀硫酸溶解,再滴加足量的浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,深蓝色溶液中阳离子的化学式为___________ , 该离子含有
该离子含有___________ mol 键,其中配位体为
键,其中配位体为___________ 分子(填“极性”或“非极性”),空间构型为___________ ;
(4)基态M原子电子占据最高能级的电子云轮廓图为___________ 形,将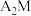 通入
通入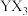 溶液中反应的离子方程式为
溶液中反应的离子方程式为___________ ;
(5)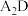 分子中
分子中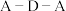 键角比
键角比 中
中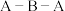 键角
键角___________ ;(填“大”或“小”)
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,C原子的杂化类型为___________ , 的石墨烯中由C原子连接成的六元环的物质的量约为
的石墨烯中由C原子连接成的六元环的物质的量约为___________  ,含有
,含有___________ 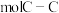 键。
键。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接___________ 个六元环,六元环中最多有___________ 个C原子在同一平面。
(7) 的晶体结构与金刚石类似。
的晶体结构与金刚石类似。 的晶体类型为
的晶体类型为___________ ,晶体中 原子与
原子与 键的数目之比为
键的数目之比为___________ 。
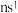 ;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。(1)D、E、M分别形成的简单离子的半径由大到小顺序为(填离子符号)
(2)元素B基态原子的核外电子排布式为
(3)Z与D形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②D的配位数是
③D周围最近的D有
④距离Z最近D的为
⑤此晶体的密度为
 ;(已知晶胞参数为anm)
;(已知晶胞参数为anm)⑥此化合物先加稀硫酸溶解,再滴加足量的浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,深蓝色溶液中阳离子的化学式为
 该离子含有
该离子含有 键,其中配位体为
键,其中配位体为(4)基态M原子电子占据最高能级的电子云轮廓图为
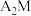 通入
通入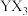 溶液中反应的离子方程式为
溶液中反应的离子方程式为(5)
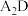 分子中
分子中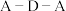 键角比
键角比 中
中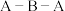 键角
键角(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,C原子的杂化类型为
 的石墨烯中由C原子连接成的六元环的物质的量约为
的石墨烯中由C原子连接成的六元环的物质的量约为 ,含有
,含有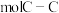 键。
键。②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
(7)
 的晶体结构与金刚石类似。
的晶体结构与金刚石类似。 的晶体类型为
的晶体类型为 原子与
原子与 键的数目之比为
键的数目之比为
您最近一年使用:0次
2 . 下列表格是元素周期表的一部分,请按要求填空。
(1)写出④⑤⑦的原子半径由大到小的顺序为___________ 。
(2)元素③和⑩形成的化合物中存在的化学键类型为___________ 。
(3)写出由①和⑥形成的化合物的电子式___________ 。
(4)元素⑪在周期表中的位置________ ,其基态原子的核外电子排布式为___________ 。
(5)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式___________ 。
(6)写出元素②基态原子的核外电子占据的能量最高的原子轨道的形状为___________ ,该基态原子的价层电子轨道表示式为___________ 。
(7)元素④的气态氢化物的VSEPR模型为___________ ,分子的空间结构为___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
(2)元素③和⑩形成的化合物中存在的化学键类型为
(3)写出由①和⑥形成的化合物的电子式
(4)元素⑪在周期表中的位置
(5)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式
(6)写出元素②基态原子的核外电子占据的能量最高的原子轨道的形状为
(7)元素④的气态氢化物的VSEPR模型为
您最近一年使用:0次
名校
3 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
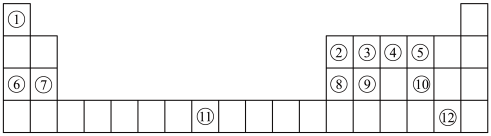
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
338次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
解题方法
4 . A、B、D、E、X是原子序数依次增大的五种短周期元素。A是周期表中相对原子质量最小的元素,A、B能形成两种液态化合物 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
(1) 的电子式为
的电子式为__________ ;离子半径D__________ B(填“>”或“<”)。
(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为__________ ,该反应可用于制备漂白液。
②试管b中的实验现象为__________ ,说明X的非金属性强于碘元素,从原子结构的角度解释其原因是__________ 。
(3)镓 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是__________ (填字母序号)。
a. 位于元素周期表的第四周期
位于元素周期表的第四周期
b. 中
中 的化合价为
的化合价为
c. 的离子半径小于
的离子半径小于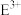 的离子半径
的离子半径
(4)工业上用 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为__________ 。
 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空) (1)
 的电子式为
的电子式为(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为
②试管b中的实验现象为
(3)镓
 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是a.
 位于元素周期表的第四周期
位于元素周期表的第四周期b.
 中
中 的化合价为
的化合价为
c.
 的离子半径小于
的离子半径小于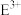 的离子半径
的离子半径(4)工业上用
 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为
您最近一年使用:0次
名校
5 . A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水均得到酸性溶液,C2D溶于水得到碱性溶液。
(1)E元素在周期表中的位置为_______________ ;C、D、E的简单离子的离子半径由大到小的顺序是________________ (用离子符号表示)。工业上制取C单质的化学方程式为__________________ 。
(2)C2B2电子式为________________ ,某溶液中含有①NO 、②HCO
、②HCO 、③SO
、③SO 、④CO
、④CO 、⑤SO
、⑤SO 5种阴离子,向其中加入C2B2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)
5种阴离子,向其中加入C2B2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化) ________________ 。
A.① B.①③⑤
C.①④⑤ D.①②④⑤
(3)化合物C2D的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程_________________
(1)E元素在周期表中的位置为
(2)C2B2电子式为
 、②HCO
、②HCO 、③SO
、③SO 、④CO
、④CO 、⑤SO
、⑤SO 5种阴离子,向其中加入C2B2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)
5种阴离子,向其中加入C2B2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化) A.① B.①③⑤
C.①④⑤ D.①②④⑤
(3)化合物C2D的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程
您最近一年使用:0次
2022-11-12更新
|
191次组卷
|
3卷引用:天津市五校2022-2023学年高三上学期期中联考化学试题
名校
解题方法
6 . 铝、硅、磷三种元素的单质及其化合物在生产生活中有广泛应用。
(1)基态硅原子的价电子的轨道表达式_______ ;第三周期元素中第一电离能介于铝和磷元素之间的有_______ (填元素符号)。
(2)比较铝、磷元素的简单离子半径_______ (用相关化学符号表示)。
(3)下列关于三种元素的化合物的叙述正确的是_______ 。
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③ 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物
(4) 与
与 比较,沸点较高的是
比较,沸点较高的是_______ ,两种分子中键角较大的是_______ ,其中 的分子构型为
的分子构型为_______ 。
(5)三种单质的晶胞结构如下
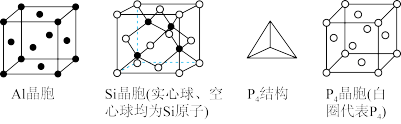
这三种晶胞中的原子的个数比为_______ 。
(6)①工业由粗硅制高纯硅的化学方程式_______ 。
②利用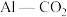 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝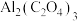 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是_______ 。

A.该电池的使用可有效利用
B.电池工作时,电流从铝电极流向多孔碳电极
C. 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂
D.含 的离子液体是熔融态的
的离子液体是熔融态的
(1)基态硅原子的价电子的轨道表达式
(2)比较铝、磷元素的简单离子半径
(3)下列关于三种元素的化合物的叙述正确的是
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③
 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物(4)
 与
与 比较,沸点较高的是
比较,沸点较高的是 的分子构型为
的分子构型为(5)三种单质的晶胞结构如下

这三种晶胞中的原子的个数比为
(6)①工业由粗硅制高纯硅的化学方程式
②利用
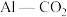 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝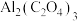 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是
A.该电池的使用可有效利用

B.电池工作时,电流从铝电极流向多孔碳电极
C.
 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂D.含
 的离子液体是熔融态的
的离子液体是熔融态的
您最近一年使用:0次
2022-06-20更新
|
476次组卷
|
2卷引用:天津市耀华中学2022届高三下学期一模化学试题
解题方法
7 . 下表列出了①~⑨九种元素在周期表中的位置元素,完成下列各小题。
(1)第3周期中金属性最强的元素是_______ (填元素名称)。
(2)⑧原子结构示意图为_______ 。
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是_______ (填化学式)。
(4)①、②和③原子半径由小到大的顺序是_______ 。
(5)第3周期中气态氢化物最稳定的是_______ (填化学式)。
(6)⑦是带来人类文明的重要元素之一,其氧化物化学式是_______ ,常用于制造_______ (填一种高性能的现代通信材料的名称)。
(7)⑥是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为_______ 。
(8)②元素形成的一种氢化物的化学式是_______ ,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的化学反应方程式_______ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)⑧原子结构示意图为
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是
(4)①、②和③原子半径由小到大的顺序是
(5)第3周期中气态氢化物最稳定的是
(6)⑦是带来人类文明的重要元素之一,其氧化物化学式是
(7)⑥是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为
(8)②元素形成的一种氢化物的化学式是
您最近一年使用:0次
8 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
(1)④、⑤、⑧的简单离子半径由大到小的顺序是___________ 。
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是___________ 。
(3)①与③能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质的电子式为___________ 。
(4)工业制⑥的单质时,电解其氧化物而不电解其氯化物的原因是___________ 。
(5)⑤在空气中加热形成化合物的化学式是___________ ,写出该物质与水反应的化学方程式___________ 。
(6)元素X与⑦同一主族,X原子比⑦原子多一个电子层,X的原子结构示意图为___________ ,其氢化物的化学式为___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)①与③能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质的电子式为
(4)工业制⑥的单质时,电解其氧化物而不电解其氯化物的原因是
(5)⑤在空气中加热形成化合物的化学式是
(6)元素X与⑦同一主族,X原子比⑦原子多一个电子层,X的原子结构示意图为
您最近一年使用:0次
9 . 完成下列问题。
Ⅰ.电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小,可用一定数值x来表示。下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:___________<x(Mg)<___________。___________
(2)指出下列两种化合物中氧元素的化合价:HClO___________ ,HFO___________ 。有机物结构式为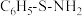 ,其中S-N中,共用电子对偏向
,其中S-N中,共用电子对偏向___________ 。
(3)成键的两原子相应元素x数值的差值为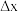 ,当
,当 时,一般为离子键,
时,一般为离子键, 时,一般为共价键,则
时,一般为共价键,则 中化学键类型是
中化学键类型是___________ 。
(4)预测元素周期表中,x值最小的元素位于___________ 周期___________ 族(放射性元素除外)。
Ⅱ.下图中反应①是制备 的一种方法,其副产物是优质的镁资源。
的一种方法,其副产物是优质的镁资源。
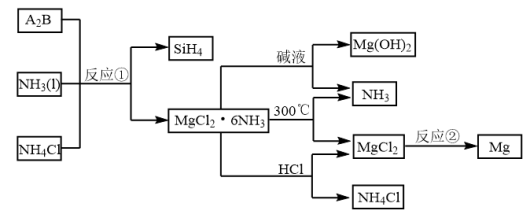
(5)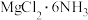 中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):
中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):___________ 。
(6)A2B的化学式为___________ 。上图中可以循环使用的物质有___________ (化学式)。
(7)一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料___________ 。
(8)为实现燃煤脱硫,煤中加入浆状 ,使燃烧产生的
,使燃烧产生的 转化为稳定的镁化合物。该反应的化学方程式:
转化为稳定的镁化合物。该反应的化学方程式:___________ 。
Ⅰ.电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小,可用一定数值x来表示。下面是某些短周期元素的x值:
| 元素 | Li | Be | B | C | N | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.0 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)指出下列两种化合物中氧元素的化合价:HClO
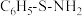 ,其中S-N中,共用电子对偏向
,其中S-N中,共用电子对偏向(3)成键的两原子相应元素x数值的差值为
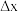 ,当
,当 时,一般为离子键,
时,一般为离子键, 时,一般为共价键,则
时,一般为共价键,则 中化学键类型是
中化学键类型是(4)预测元素周期表中,x值最小的元素位于
Ⅱ.下图中反应①是制备
 的一种方法,其副产物是优质的镁资源。
的一种方法,其副产物是优质的镁资源。
(5)
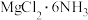 中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):
中所含元素的简单离子半径由小到大的顺序(氢元素的简单离子只考虑H+):(6)A2B的化学式为
(7)一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料
(8)为实现燃煤脱硫,煤中加入浆状
 ,使燃烧产生的
,使燃烧产生的 转化为稳定的镁化合物。该反应的化学方程式:
转化为稳定的镁化合物。该反应的化学方程式:
您最近一年使用:0次
解题方法
10 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语 回答下列问题:

(1)④、⑤、⑧的简单离子半径由大到小的顺序是___________ 。
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是___________ 。
(3)①与③能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质的电子式为___________ 。
(4)工业制⑥的单质时,电解其氧化物而不电解其氯化物的原因是___________ 。
(5)②在空气中燃烧形成化合物的化学式是___________ ,高温灼烧该化合物时,火焰呈___________ 色。
(6)元素X与⑦同一主族,X原子比⑦原子多一个电子层,X的原子结构示意图为___________ ,其氢化物的化学式为___________ 。

(1)④、⑤、⑧的简单离子半径由大到小的顺序是
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)①与③能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质的电子式为
(4)工业制⑥的单质时,电解其氧化物而不电解其氯化物的原因是
(5)②在空气中燃烧形成化合物的化学式是
(6)元素X与⑦同一主族,X原子比⑦原子多一个电子层,X的原子结构示意图为
您最近一年使用:0次



