名校
解题方法
1 . 物质之间的转化关系如图,部分生成物省略。A是由四种元素组成的化合物。C、D是由元素X、Y、Z中两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用。
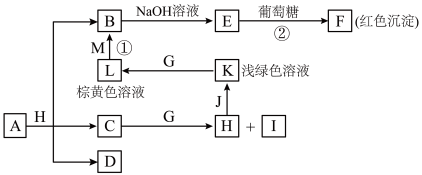
请回答下列问题:
(1)C的电子式____ 。
(2)写出反应①的离子反应方程式____ ,反应②中体现葡萄糖的____ 性。
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。____
(4)写出A的化学式____ 。
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式____ 。
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式____ ,N的一种同素异形体的名称为____ 。

请回答下列问题:
(1)C的电子式
(2)写出反应①的离子反应方程式
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。
(4)写出A的化学式
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式
您最近一年使用:0次
2022-09-20更新
|
344次组卷
|
5卷引用:江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷
名校
2 . A、B、C、D、E为五种短周期主族元素,且原子序数依次增大,五种元素的原子序数之和为39,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等。
(1)A2C2的结构式为___________ 。
(2)E元素在元素周期表中的位置为___________ 。
(3)C、D、E三种元素的简单离子半径由小到大的顺序为___________ (填离子符号)。
(4)若要比较D和E的金属性强弱,下列实验方案不可行的是___________ (填标号)。
A.将D的单质置于E的盐溶液中,若D的单质不能置换出E的单质,说明D的金属性弱
B.将少量D、E的单质分别投入水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的碱性,若D的最高价氧化物对应水化物的碱性强,说明D的金属性强
(5)用 和
和 组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示:
组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示: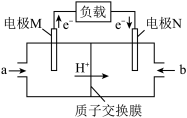
电极N是___________ (填“正极”或“负极”),电极M上的电极反应式为___________ 。
(1)A2C2的结构式为
(2)E元素在元素周期表中的位置为
(3)C、D、E三种元素的简单离子半径由小到大的顺序为
(4)若要比较D和E的金属性强弱,下列实验方案不可行的是
A.将D的单质置于E的盐溶液中,若D的单质不能置换出E的单质,说明D的金属性弱
B.将少量D、E的单质分别投入水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的碱性,若D的最高价氧化物对应水化物的碱性强,说明D的金属性强
(5)用
 和
和 组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示:
组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示:
电极N是
您最近一年使用:0次
2021-12-13更新
|
281次组卷
|
2卷引用:江西省丰城中学 2021-2022 学年高三上学期第四次段考化学试题(尖子重点班)
名校
3 . 短周期元素X、Y、M、N是同周期主族元素,M元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型的锂离子电池的电解质,结构如图所示(“→”表示配位键,指共价键中共用的电子对是由其中一原子独自供应)。

回答下列问题:
(1)Y元素在元素周期表中的位置___ ,该元素形成的一元弱酸H3YO3能促进水的电离,原因是___ (用离子方程式表示)。
(2)X、M形成的简单离子半径大小关系为__ (用离子符号表示);X、M形成的某种气态化合物MX2具有强氧化性,能与水缓慢反应,写出该反应的化学方程式__ 。
(3)M、N能形成某种无色无味的有毒气体A,当其浓度达到一定数值将对人体产生致命伤害。如图所示装置能测定该物质的浓度,电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动,传感器中的电流越大,则该有毒气体A的浓度越大,则a电极的电极反应式为___ 。


回答下列问题:
(1)Y元素在元素周期表中的位置
(2)X、M形成的简单离子半径大小关系为
(3)M、N能形成某种无色无味的有毒气体A,当其浓度达到一定数值将对人体产生致命伤害。如图所示装置能测定该物质的浓度,电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动,传感器中的电流越大,则该有毒气体A的浓度越大,则a电极的电极反应式为

您最近一年使用:0次
2021-11-14更新
|
187次组卷
|
2卷引用:江西省赣州市十六县(市)十七校2021-2022学年高三上学期期中联考化学试题
解题方法
4 . 物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为地壳含量最高的金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:
回答下列问题:

(1)Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是_________ ,写出YX的电子式_________ 。
(2)比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)_________ 。
(3)在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式_____________________________________________ 。
回答下列问题:

(1)Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是
(2)比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)
(3)在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式
您最近一年使用:0次
2020-09-11更新
|
237次组卷
|
3卷引用:江西省景德镇市2022届高三第一次模拟化学试题
江西省景德镇市2022届高三第一次模拟化学试题安徽省蚌埠市2021届高三上学期第一次质量监测化学试题(已下线)专题16 元素周期律和元素周期表(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
19-20高三上·江西南昌·期中
5 . 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是______ (写元素符号);
(2)Z在元素周期表中的位置为____ ;
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是____ (写化学式);
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是______ (写名称);
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为______________ ;
(6)常温下,不能与G的单质发生反应的是___ (填标号);
a CuSO4溶液 b 浓硫酸 c NaOH溶液 d 浓硝酸 e 氧化铜
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是
(2)Z在元素周期表中的位置为
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为
(6)常温下,不能与G的单质发生反应的是
a CuSO4溶液 b 浓硫酸 c NaOH溶液 d 浓硝酸 e 氧化铜
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________ 。
(2)A与F形成离子化物FA的电子式为___________ 。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______ 。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________ 。16g该物质反应转移的电子数目为________ 。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________ (简要说明原理和现象即可)。
(1)G是E下一周期同主族元素,G的原子结构示意图为
(2)A与F形成离子化物FA的电子式为
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为
(5)请设计最简单实验说明元素D、E的非金属性强弱:
您最近一年使用:0次
2019-11-20更新
|
118次组卷
|
3卷引用:江西省南昌市第二中学2020届高三第四次月考化学试题
名校
7 . 元素周期表中的四种元素的有关信息如下,请用合理的化学用语 填写空白。
(1)X元素周期表中的位置为_____ ,X、Y、W三种元素的简单离子半径从大到小的顺序为_______ 。
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式_____ 。
(3)下列有关W的气态氢化物丁的说法正确的有_______ (选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________ 。
| 在周期表中的区域 | 元素代号 | 有关信息 |
| 短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
| Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
| 长周期元素 | Z | Z的一种盐乙可以做净水剂, 的某种氧化物丙可以做红色涂料 的某种氧化物丙可以做红色涂料 |
| W | W元素大量存在于海藻中,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式
(3)下列有关W的气态氢化物丁的说法正确的有
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式
您最近一年使用:0次
8 . A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
(1)推断B在元素周期表中的位置______________ ,写出E2D的电子式__________ .
(2)写出A与D形成的10电子阳离子的化学式______________ .
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_______________ .
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式________________________ .
(5)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2g.下列说法正确的是_____________ .
A.m1一定大于m2
B.剩余固体m2中一定没有单质Cu
C.加入稀硫酸前、后的溶液中肯定都有Fe2+
D.加入稀硫酸前、后的溶液中肯定都有Cu2+
(1)推断B在元素周期表中的位置
(2)写出A与D形成的10电子阳离子的化学式
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式
(5)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2g.下列说法正确的是
A.m1一定大于m2
B.剩余固体m2中一定没有单质Cu
C.加入稀硫酸前、后的溶液中肯定都有Fe2+
D.加入稀硫酸前、后的溶液中肯定都有Cu2+
您最近一年使用:0次
2019-01-30更新
|
237次组卷
|
2卷引用:2016届江西省宜春市铜鼓中学高三二模化学试卷
名校
9 . Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
(1)M在元素周期表中的位置为________________ 。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________ ;所含化学键类型_________ 。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________ 。
Ⅱ.如下图转化关系: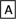
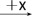
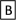
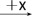
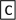
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________ 。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________ 。
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(2)X与Y按原子个数比2∶1构成的物质的电子式为
(3)X+、 Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
Ⅱ.如下图转化关系:
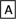
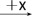
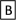
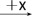
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为
您最近一年使用:0次
2018-11-16更新
|
376次组卷
|
2卷引用:江西省安远县第一中学2020届高三上学期第三次月考化学试题
名校
10 . 短周期元素A、B、C、D在周期表中位置如图所示,其中元素D原子最外层有3个电子。请用相应 的化学用语回答:
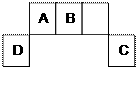
(1)A与氢元素可以形成很多化合物,在这些化合物中都含有_________ (选填“共价”或“离子”)键;与C相邻且最外层电子比C少1个的离子结构示意图为 _________________ 。B在元素周期表中位于____________________ 。B、C、D形成的离子的半径由大到小 依次为 _________________ 。(填相应的离子符号)
(2)元素A形成的最简单氢化物和氧气在KOH溶液中可构成燃料电池,该电池工作时正极 的电极反应式为 ___________________________________ 。
(3)D的最高价氧化物的水化物与NaOH反应的化学 方程式是:
________________________________________ 。
(4)由A与S形成的液态 化合物AS2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215 kJ。 该反应的热化学方程式为_________________________________ 。
(5)已知298K时,Fe(s) + O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-1
O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-1
2D(s) + O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1
O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1
写出D单质和FeO反应的热化学方程式是_____________________________________ 。

(1)A与氢元素可以形成很多化合物,在这些化合物中都含有
(2)元素A形成的最简单氢化物和氧气在KOH溶液中可构成燃料电池,该电池工作时
(3)D的最高价氧化物的水化物与NaOH反应的
(4)由A与S形成的
(5)已知298K时,Fe(s) +
 O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-1
O2(g) == FeO(s) ; ΔH= -272.0 kJ · mol-12D(s) +
 O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1
O2(g) == D2O3(s) ; ΔH= -1675.7 kJ · mol-1写出D单质和FeO反应的热化学方程式是
您最近一年使用:0次



