解题方法
1 . 一种新型硫酸盐功能电解液由2mol·L-1Na2SO4和0.3mol·L-1MgSO4混合组成,电化学测试表明该电解液构建的Na2Ni[Fe(CN)6]、NaTi2(PO4)3/C电池可以稳定循环500次以上。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是___________ (用元素符号表示),其中电负性最大的元素是___________ (填名称)。
(2)第一电离能N>O的原因是___________ 。
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有___________ 种,[Fe(CN)6]4-中σ键和π键的数目之比为___________ 。
(4)NaTi2(PO4)3中, 中磷原子的杂化类型是
中磷原子的杂化类型是___________ 。
(5)N、O两种元素形成的简单氢化物的熔点:NH3___________ H2O(填“>”“<”或“=”),其原因是___________ 。
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=___________ 。
②该晶体密度是___________ g·cm-3(用含n、NA的代数式表示)。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是
(2)第一电离能N>O的原因是
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有
(4)NaTi2(PO4)3中,
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的熔点:NH3
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=
②该晶体密度是
您最近一年使用:0次
2023-04-26更新
|
279次组卷
|
3卷引用:新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题
新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题河南省名校大联考2023届高三下学期三模考试理综化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
名校
2 . 如表是元素周期表主族元素的一部分,请参照元素①~⑥在表中的位置,回答下列问题:

(1)②在周期表中的位置______ 。
(2)①的简单氢化物的电子式______ 。
(3)③④⑤形成的简单离子半径由大到小的排序是______ (用离子符号表示)。
(4)用电子式表示③和⑥形成的化合物的过程______ 。
(5)写出⑤单质与③的最高价氧化物对应水化物反应的离子方程式______ 。
(6)③和④中金属性强的是______ (填“元素符号”),以下说法能证明该结论的是______ 。
a.③容易失去1个e-,而④容易失去2个e-
b.③与冷水剧烈反应,而④与冷水反应缓慢
c.③和④的最高价氧化物对应水化物的碱性:③>④
(7)硒(Se)位于第四周期,与②同主族。下列推断不正确 的是______ 。
a.Se最低价为-2价
b.Se单质常温下也呈气态,只有氧化性
c.沸点:H2Se<H2O

(1)②在周期表中的位置
(2)①的简单氢化物的电子式
(3)③④⑤形成的简单离子半径由大到小的排序是
(4)用电子式表示③和⑥形成的化合物的过程
(5)写出⑤单质与③的最高价氧化物对应水化物反应的离子方程式
(6)③和④中金属性强的是
a.③容易失去1个e-,而④容易失去2个e-
b.③与冷水剧烈反应,而④与冷水反应缓慢
c.③和④的最高价氧化物对应水化物的碱性:③>④
(7)硒(Se)位于第四周期,与②同主族。下列推断
a.Se最低价为-2价
b.Se单质常温下也呈气态,只有氧化性
c.沸点:H2Se<H2O
您最近一年使用:0次
2023-04-23更新
|
169次组卷
|
2卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
3 . 已知A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。回答下列问题:
(1)B、C、G的简单氢化物中稳定性最弱的是____ (填化学式)。
(2)G的某种氧化物能使酸性KMnO4溶液褪色,反应的离子方程式为____ 。
(3)B、C、D、E、F形成的简单离子半径由小到大的顺序为____ (用离子符号表示)。
(4)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为____ ,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是____ 。
(5)F的最高价氧化物对应的水化物和D的最高价氧化物对应的水化物的水溶液发生反应的离子方程式为____ 。
(1)B、C、G的简单氢化物中稳定性最弱的是
(2)G的某种氧化物能使酸性KMnO4溶液褪色,反应的离子方程式为
(3)B、C、D、E、F形成的简单离子半径由小到大的顺序为
(4)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为
(5)F的最高价氧化物对应的水化物和D的最高价氧化物对应的水化物的水溶液发生反应的离子方程式为
您最近一年使用:0次
2022-10-30更新
|
273次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2022-2023学年高三第一次模拟考试化学试题
名校
解题方法
4 . 下表列出了①~⑩十种元素在周期表中的位置:
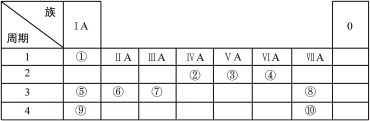
请按要求回答下列问题:
(1)元素⑤的离子结构示意图为_______ ;元素②的最高价氧化物的电子式是_______ 。
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是_______ (填元素符号);这三种元素最高价氧化物对应水化物中碱性最强的是_______ (填化学式)。
(3)③、④元素的简单氢化物的稳定性较弱的是_______ (填化学式)。
(4)①、②、④三种元素形成的有机物的分子结构模型如下图所示,写出该有机物的结构简式:_______ ;

①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:_______ 。
(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式;_______ 。
(6)写出元素⑨的单质与水反应的化学方程式:_______ 。
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:_______ 。

请按要求回答下列问题:
(1)元素⑤的离子结构示意图为
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是
(3)③、④元素的简单氢化物的稳定性较弱的是
(4)①、②、④三种元素形成的有机物的分子结构模型如下图所示,写出该有机物的结构简式:

①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:
(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式;
(6)写出元素⑨的单质与水反应的化学方程式:
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:
您最近一年使用:0次
2022-06-17更新
|
177次组卷
|
2卷引用:新疆塔城地区第二中学2022-2023学年高三上学期11月月考化学(A)试题
名校
解题方法
5 . 亚硝酰氯NOCl常用于合成洗涤剂、触媒及用作中间体,其熔点为-64.5℃,沸点-5.5℃,遇水易水解为两种酸。某学习小组在实验室用 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
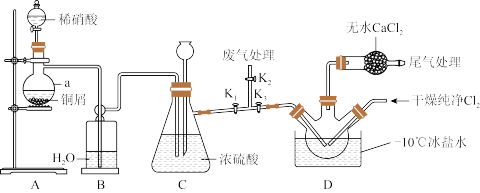
(1)实验室用 制取
制取 的离子方程式为
的离子方程式为_______ 。
(2)装置A中仪器a的名称为_______ ,装置C中长颈漏斗的作用是_______ 。
(3)若不用装置D中的干燥管,对实验有何影响_______ (用化学方程式表示)。
(4)N、O、Cl的简单离子中半径最小的是_______ (填离子符号),简单氢化物的熔沸点由高到低的顺序是_______ (用化学式表示)。
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用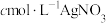 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为_______ 。
 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
(1)实验室用
 制取
制取 的离子方程式为
的离子方程式为(2)装置A中仪器a的名称为
(3)若不用装置D中的干燥管,对实验有何影响
(4)N、O、Cl的简单离子中半径最小的是
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用
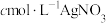 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
您最近一年使用:0次
2022-05-29更新
|
305次组卷
|
3卷引用:新疆生产建设兵团第六师五家渠高级中学2022-2023学年高三2月月考化学试题
6 . 部分短周期元素的最高正化合价或最低负化合价与原子序数的关系如图所示(已知a为非金属元素)。

(1)由a、c、d三种元素形成的离子化合物的化学式为___________ 。
(2)图中所示元素中金属性最强的是___________ (填元素符号),工业上制取该元素的单质的原理为___________ (填化学方程式)。
(3)e、f、g元素的简单离子半径由大到小的顺序为___________ (用离子符号回答)。
(4)常温下,h的单质与化合物 的稀溶液反应,氧化产物为
的稀溶液反应,氧化产物为___________ (填化学式)。
(5) 可用于处理碱性工业废水中的
可用于处理碱性工业废水中的 ,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为
,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为___________ 。

(1)由a、c、d三种元素形成的离子化合物的化学式为
(2)图中所示元素中金属性最强的是
(3)e、f、g元素的简单离子半径由大到小的顺序为
(4)常温下,h的单质与化合物
 的稀溶液反应,氧化产物为
的稀溶液反应,氧化产物为(5)
 可用于处理碱性工业废水中的
可用于处理碱性工业废水中的 ,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为
,发生氧化还原反应,产物为一种酸根离子和常见的碱性气体,发生反应的离子方程式为
您最近一年使用:0次
名校
7 . 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是____ 。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____ >____ ;比较g、h的最高价氧化物对应水化物的酸性强弱:____ >____ 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________ 。
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:_________________ 。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如图:
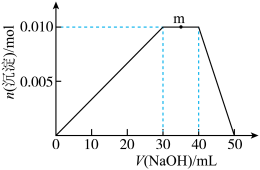
①R化学式为:________ ,其物质的量为________ 。
②写出m点反应的离子方程式:_________ 。
③若在R溶液中改加20 mL 1.1 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_____ mol。

根据判断出的元素回答问题:
(1)f在周期表中的位置是
(2)比较d、e常见离子的半径大小(用化学式表示,下同):
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如图:

①R化学式为:
②写出m点反应的离子方程式:
③若在R溶液中改加20 mL 1.1 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
2020-10-31更新
|
135次组卷
|
2卷引用:新疆乌鲁木齐市第六十八中学2023-2024学年高三上学期1月月考化学试题
名校
8 . 根据元素在周期表中的位置能推测元素的原子结构以及相关物质的性质,下图是元素周期表的一部分,请根据图中字母所示元素的位置回答问题。
(1)元素P的原子结构示意图为________ ;元素 的最高价氧化物的电子式为
的最高价氧化物的电子式为________ 。
(2)元素 、
、 、
、 形成的简单离子中,半径由大到小的顺序为
形成的简单离子中,半径由大到小的顺序为_______ (填离子符号)。
(3)下列说法中,正确的有________ (填序号)。
①元素 的单质有多种同素异形体 ②
的单质有多种同素异形体 ② 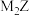 中仅含离子键,
中仅含离子键, 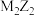 中仅含共价键
中仅含共价键
③ 和
和 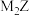 都是离子化合物 ④
都是离子化合物 ④ 比
比  的沸点更高
的沸点更高
(4)已知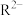 离子的核内有
离子的核内有 个中子,
个中子, 的质量数为
的质量数为 ,则
,则 离子里含有电子的物质的量为
离子里含有电子的物质的量为_____  。
。
X | |||||||||||||||||
Y | Z | ||||||||||||||||
M | N | W | T | ||||||||||||||
P |
(1)元素P的原子结构示意图为
 的最高价氧化物的电子式为
的最高价氧化物的电子式为(2)元素
 、
、 、
、 形成的简单离子中,半径由大到小的顺序为
形成的简单离子中,半径由大到小的顺序为(3)下列说法中,正确的有
①元素
 的单质有多种同素异形体 ②
的单质有多种同素异形体 ② 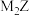 中仅含离子键,
中仅含离子键, 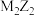 中仅含共价键
中仅含共价键③
 和
和 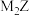 都是离子化合物 ④
都是离子化合物 ④ 比
比  的沸点更高
的沸点更高(4)已知
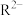 离子的核内有
离子的核内有 个中子,
个中子, 的质量数为
的质量数为 ,则
,则 离子里含有电子的物质的量为
离子里含有电子的物质的量为 。
。
您最近一年使用:0次
2020-07-29更新
|
24次组卷
|
2卷引用:新疆莎车县第一中学2022-2023学年高三上学期11月月考化学试题
名校
解题方法
9 . A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个;F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)F的三种核素表示符号为_______ ,E的名称为_______ ,D的最高价氧化物的水化物的电子式:_______ 。
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是_______ ,离子半径最大的是_______ 。(填离子符号)
(3)A、B、C的氢化物稳定性顺序为_______ (用分子式表示);B的氢化物和B的最高价氧化物的水化物反应生成Z,反应中断裂化学键是_______ ,形成的化学键是_______ 。(填“离子键”、“极性键”、“非极性键”、“氢键”)
(4)F2C和F2E中,沸点较高的是_______ (填化学式),其主要原因是_______ 。
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_______ 。
(1)F的三种核素表示符号为
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是
(3)A、B、C的氢化物稳定性顺序为
(4)F2C和F2E中,沸点较高的是
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为
您最近一年使用:0次
2017-04-15更新
|
173次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
10 . A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
回答下列问题
(1)元素B的元素符号是:____________ 化合物丙的电子式为________________ 。化合物丁存在的化学键类型是_________ 。
(2)化合物甲的沸点比戊____________ (填“高”或“低”),B、C、D原子半径从大到小依次为_______________ (用元素符号)
(3)向含有0.2 mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为_________ NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将_____________ ;放电一段时间KOH的物质的量_________ (填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:__________________________________ 。
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:
(2)化合物甲的沸点比戊
(3)向含有0.2 mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将
(5)用电子式表示己的形成过程:
您最近一年使用:0次
2016-12-09更新
|
449次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期1月月考化学试题



