真题
1 . 硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为________ ,分子中氮原子的杂化轨道类型是_______ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②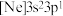 、③
、③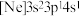 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。

(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②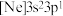 、③
、③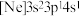 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |

您最近一年使用:0次
2023-01-11更新
|
9104次组卷
|
8卷引用:2023年1月浙江省普通高校招生选考化学试题
2023年1月浙江省普通高校招生选考化学试题(已下线)2023年1月浙江省普通高校招生选考变式题(结构与性质)(已下线)专题20 结构与性质(已下线)2023年高考化学真题完全解读(浙江1月)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
2 . 近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_________________________ 。
(2)Fe成为阳离子时首先失去______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________ 。
(3)比较离子半径:F−__________ O2−(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________ ,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________ g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(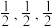 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为__________ 、__________ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)比较离子半径:F−
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
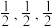 ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次
2019-06-09更新
|
14262次组卷
|
17卷引用:2019年全国统一考试化学试题(新课标Ⅱ)
2019年全国统一考试化学试题(新课标Ⅱ)四川省泸州市泸县第二中学2020届高三上学期开学考试理综化学试题2020年闽粤赣三省十二校高三联合调研考试理综化学试题西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题安徽省六安市城南中学2021届高三上学期第一次月考化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题20 结构与性质(已下线)T35-物质结构与性质甘肃省兰州市第一中学2019-2020学年高二下学期4月月考化学试题
真题
解题方法
3 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: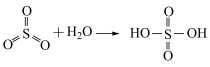
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: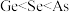 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
4 . 化合物X由3种短周期元素组成,某兴趣小组按如下流程进行实验。溶液D焰色反应为紫红色,气体B能使湿润的红色石蕊试纸变蓝。

请回答:
(1)组成X的3种元素是_______ (填元素符号),其中非金属元素形成的所有 单核离子半径由大到小的顺序为_______ 。
(2)将足量气体B通入硫酸铜溶液,得到深蓝色溶液,写出该反应的离子方程式_______ ,溶液E中溶质的成分为_______ (用化学式表示)。
(3)写出A→D的化学方程式是_______ 。
(4)在X的3种元素中,由相对分子质量最小的元素组成的单质与一定量的金属钠反应,请设计实验方案,验证反应结束后固体的成分_______ 。

请回答:
(1)组成X的3种元素是
(2)将足量气体B通入硫酸铜溶液,得到深蓝色溶液,写出该反应的离子方程式
(3)写出A→D的化学方程式是
(4)在X的3种元素中,由相对分子质量最小的元素组成的单质与一定量的金属钠反应,请设计实验方案,验证反应结束后固体的成分
您最近一年使用:0次
2022-04-14更新
|
1215次组卷
|
3卷引用:浙江省台州市2022届高三下学期4月教学质量评估(二模)化学试题
名校
解题方法
5 . N、P及其化合物在工业生产中起着重要的作用。回答下列问题:
(1)由磷原子核形成的三种微粒:a.([Ne]3s23p3)、b.([Ne]3s23p2)、c.([Ne]3s23p24s1),半径由大到小的顺序为___________ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)已知HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式___________ 。
(3)杂环化合物咪唑结构如图,其分子中的大π键可表示为 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是___________ (填“①”或“②”),其原因是___________ 。

(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如下图所示。已知该晶胞中原子的分数坐标如下:Cu:(0,0, );(0,
);(0, ,0);(
,0);( ,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有___________ 个,则该化合物的化学式为___________ 。

(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式___________ 。
②若晶胞参数为anm,则晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)由磷原子核形成的三种微粒:a.([Ne]3s23p3)、b.([Ne]3s23p2)、c.([Ne]3s23p24s1),半径由大到小的顺序为
(2)已知HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式
(3)杂环化合物咪唑结构如图,其分子中的大π键可表示为
 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是
(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如下图所示。已知该晶胞中原子的分数坐标如下:Cu:(0,0,
 );(0,
);(0, ,0);(
,0);( ,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式
②若晶胞参数为anm,则晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024-01-22更新
|
673次组卷
|
2卷引用:山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题
22-23高一上·全国·课时练习
名校
6 . 图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:

(1)②在周期表中的位置是___________ 。
(2)①~⑧中,化学性质最稳定的是___________ (填元素符号),非金属性最强的是___________ (填元素符号),最高价氧化物对应水化物酸性最强的是___________ (填化学式)。
(3)①~⑦中,原子半径最大的是___________ (填元素符号)。
(4)元素③的非金属性比⑥___________ (填“强”或“弱”),请从原子结构的角度解释:___________ ,列举一个化学事实加以说明___________ 。
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。
工业制备镓的流程如下图所示:
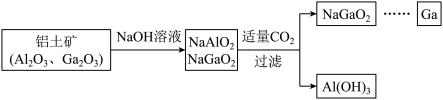
氧化镓与NaOH反应的化学方程式为___________ 。酸性:Al(OH)3___________ Ga(OH)3(填“>”或“<”),冶炼金属镓的方法是___________ (填序号)。
A.热还原法 B.热分解法 C.电解法

(1)②在周期表中的位置是
(2)①~⑧中,化学性质最稳定的是
(3)①~⑦中,原子半径最大的是
(4)元素③的非金属性比⑥
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。
工业制备镓的流程如下图所示:

氧化镓与NaOH反应的化学方程式为
A.热还原法 B.热分解法 C.电解法
您最近一年使用:0次
解题方法
7 . 黄血盐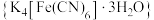 是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠
是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠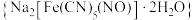 、赤血盐
、赤血盐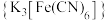 等。
等。
(1)基态铁原子核外电子排布式为_______ 。
(2)赤血盐中主族元素的电负性由大到小的顺序为_______ 。
(3)比较中心金属离子半径大小:黄血盐_______ 赤血盐(填“>”或“<”)。
(4)已知硝普钠和黄血盐的中心金属离子半径相等,硝普钠中铁的配位数是_______ ,配体为CN-、_______ 。
(5)碘酸钾也是一种食盐添加剂,其阴离子碘酸根( )的中心原子的杂化方式为
)的中心原子的杂化方式为_______ , 的空间构型是
的空间构型是_______ 。
(6)赤血盐与Fe2+反应可生成蓝色沉淀滕氏蓝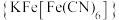 。滕氏蓝晶体中含有的作用力包括
。滕氏蓝晶体中含有的作用力包括_______ (填标号)。
A.极性共价键 B.非极性共价键 C.离子键 D.金属键 E.氢键
(7)滕氏蓝的晶胞由8个如图所示的小立方体构成(K+未标出)。
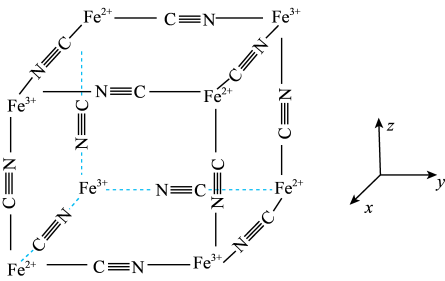
①已知K+位于小立方体的体心,但不是每个小立方体的体心都含有K+。根据化学式推断,一个滕氏蓝晶胞中含有的K+的个数为_______ 。
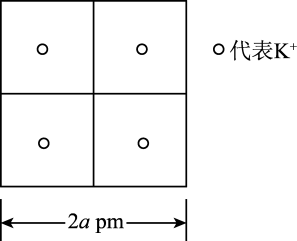
②滕氏蓝的晶胞沿x、y或z轴任意一个方向投影的K+的位置如图所示。晶胞中两个K+之间的最短距离为_______ pm,滕氏蓝晶体的密度为_______ g/cm3(列出计算式)。(已知:滕氏蓝的式量为Mr,阿伏加德罗常数的值为NA)
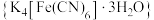 是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠
是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠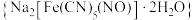 、赤血盐
、赤血盐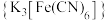 等。
等。(1)基态铁原子核外电子排布式为
(2)赤血盐中主族元素的电负性由大到小的顺序为
(3)比较中心金属离子半径大小:黄血盐
(4)已知硝普钠和黄血盐的中心金属离子半径相等,硝普钠中铁的配位数是
(5)碘酸钾也是一种食盐添加剂,其阴离子碘酸根(
 )的中心原子的杂化方式为
)的中心原子的杂化方式为 的空间构型是
的空间构型是(6)赤血盐与Fe2+反应可生成蓝色沉淀滕氏蓝
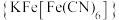 。滕氏蓝晶体中含有的作用力包括
。滕氏蓝晶体中含有的作用力包括A.极性共价键 B.非极性共价键 C.离子键 D.金属键 E.氢键
(7)滕氏蓝的晶胞由8个如图所示的小立方体构成(K+未标出)。

①已知K+位于小立方体的体心,但不是每个小立方体的体心都含有K+。根据化学式推断,一个滕氏蓝晶胞中含有的K+的个数为
②滕氏蓝的晶胞沿x、y或z轴任意一个方向投影的K+的位置如图所示。晶胞中两个K+之间的最短距离为

您最近一年使用:0次
8 . 硫、氮的化合物及其相互转化在促进社会进步、资源利用和环境保护中具有重要价值。
(1)下列与氮氧化物无关的环境问题是______。
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液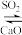 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是___________ 。(用化学方程式表示)
(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是___________ 。
②上述反应中的各物质属于共价化合物是______ ;氧化剂是_______ 。
③配平上述反应方程式,并标出电子转移的方向和数目______ 。
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:________ 。
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c( )最大的是______。
)最大的是______。
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式___________ 。
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是________ 。
(1)下列与氮氧化物无关的环境问题是______。
| A.酸雨 | B.白色污染 | C.光化学烟雾 | D.温室效应 |
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液
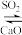 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是
②上述反应中的各物质属于共价化合物是
③配平上述反应方程式,并标出电子转移的方向和数目
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c(
 )最大的是______。
)最大的是______。| A.氨水 | B.NH4Cl | C.NH4HCO3 | D.NH4HSO4 |
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是
您最近一年使用:0次
名校
解题方法
9 . 卤族元素的单质及化合物性质丰富,在科研和生产中有许多重要用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,其中电负性最大的是___________ (填元素符号),溴原子的M能层电子排布式为___________ 。
(2)基态氯原子核外有___________ 种运动状态不同的电子,其中单电子占据的轨道形状为___________ 。
(3)下列物质性质递变规律正确的是___________。
(4)碘在水中的溶解度小,在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2
 。
。 离子的空间构型为
离子的空间构型为___________ 。
(5)SiCl4发生水解的机理如图:
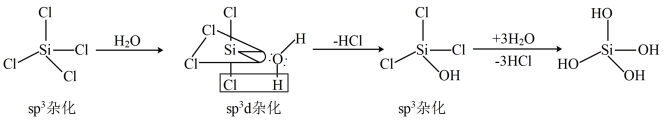
CCl4不能按照上述机理发生水解反应,原因是___________ 。
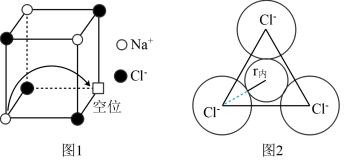
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确____________ 。(已知: ≈1.414,
≈1.414, ≈1.732)
≈1.732)
(1)卤族元素位于元素周期表的
(2)基态氯原子核外有
(3)下列物质性质递变规律正确的是___________。
| A.原子半径: F<C1<Br<I |
| B.第一电离能: F<Cl<Br<I |
| C.沸点:HCl<HBr<HI<HF |
| D.熔点: CaF2<CaCl2<CaBr2<CaI2 |

 。
。 离子的空间构型为
离子的空间构型为(5)SiCl4发生水解的机理如图:

CCl4不能按照上述机理发生水解反应,原因是
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确
 ≈1.414,
≈1.414, ≈1.732)
≈1.732)
您最近一年使用:0次
名校
解题方法
10 . 铝、硅、磷三种元素的单质及其化合物在生产生活中有广泛应用。
(1)基态硅原子的价电子的轨道表达式_______ ;第三周期元素中第一电离能介于铝和磷元素之间的有_______ (填元素符号)。
(2)比较铝、磷元素的简单离子半径_______ (用相关化学符号表示)。
(3)下列关于三种元素的化合物的叙述正确的是_______ 。
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③ 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物
(4) 与
与 比较,沸点较高的是
比较,沸点较高的是_______ ,两种分子中键角较大的是_______ ,其中 的分子构型为
的分子构型为_______ 。
(5)三种单质的晶胞结构如下
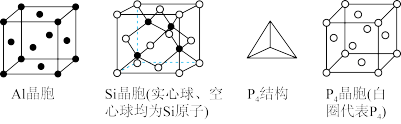
这三种晶胞中的原子的个数比为_______ 。
(6)①工业由粗硅制高纯硅的化学方程式_______ 。
②利用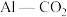 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝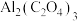 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是_______ 。

A.该电池的使用可有效利用
B.电池工作时,电流从铝电极流向多孔碳电极
C. 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂
D.含 的离子液体是熔融态的
的离子液体是熔融态的
(1)基态硅原子的价电子的轨道表达式
(2)比较铝、磷元素的简单离子半径
(3)下列关于三种元素的化合物的叙述正确的是
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③
 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物(4)
 与
与 比较,沸点较高的是
比较,沸点较高的是 的分子构型为
的分子构型为(5)三种单质的晶胞结构如下

这三种晶胞中的原子的个数比为
(6)①工业由粗硅制高纯硅的化学方程式
②利用
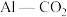 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝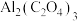 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是
A.该电池的使用可有效利用

B.电池工作时,电流从铝电极流向多孔碳电极
C.
 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂D.含
 的离子液体是熔融态的
的离子液体是熔融态的
您最近一年使用:0次
2022-06-20更新
|
476次组卷
|
2卷引用:天津市耀华中学2022届高三下学期一模化学试题



