1 . 现有下列短周期元素性质的数据,试回答下列问题:
(1)上述元素中处于ⅤA族的有:_____ (用编号表示)。
(2)处于第二周期的元素有:______ (用编号表示)。
(3)写出②、⑤的元素符号:______ 、______ 。
(4)能形成两性氢氧化物和两性氧化物的元素为______ (用编号表示)。
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.73 | 1.30 | 1.24 | 1.06 | 0.99 | 1.54 | 0.75 | 1.18 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于ⅤA族的有:
(2)处于第二周期的元素有:
(3)写出②、⑤的元素符号:
(4)能形成两性氢氧化物和两性氧化物的元素为
您最近半年使用:0次
名校
解题方法
2 . 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第ⅤA族,甲与丙同主族,丁原子最外层电子数与电子层数相等,则下列说法正确的是
| A.原子半径:丁>丙>乙 |
| B.单质的还原性:丁>丙 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
您最近半年使用:0次
2020-07-28更新
|
155次组卷
|
2卷引用:甘肃省武威市民勤县第一中学2019-2020学年高一下学期期末考试(理)化学试题
名校
解题方法
3 . 有甲、乙、丙、丁、戊五种元素,已知:甲元素是地壳中含量最高的元素;乙元素为金属元素,它的原子核外K、L层电子数之和等于M.N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素的单质中燃烧火焰呈苍白色;戊元素的最高价氧化物对应水化物既能和酸反应又能和碱反应.
(1)试推断并写出甲、乙、丙、丁、戊五种元素的元素符号:
甲:_____ ;乙:_____ ;丙:_____ ;丁:_____ ;戊:_____ ;
(2)甲元素在元素周期表中的位置:第_____ 周期第_____ 族
(3)丙元素与丁元素形成的化合物中的化学键是_____ 键;
(4)丙、丁、戊三种元素的原子半径由大至小的顺序_____ ;
(5)写出戊元素的最高价氧化物对应水化物的化学式_____ ;
(1)试推断并写出甲、乙、丙、丁、戊五种元素的元素符号:
甲:
(2)甲元素在元素周期表中的位置:第
(3)丙元素与丁元素形成的化合物中的化学键是
(4)丙、丁、戊三种元素的原子半径由大至小的顺序
(5)写出戊元素的最高价氧化物对应水化物的化学式
您最近半年使用:0次
解题方法
4 . 短周期主族元素W、X、Y、Z在元素周期表中的相对位置如图所示,其中元素X无正化合价。则下列说法正确的是
| W | X |
| Y | Z |
| A.原子半径:Y>Z>X>W |
| B.X、Y中非金属性最强的是X |
| C.X、Y、Z、W的常见单质均为气体 |
| D.X、Y、Z元素形成的氢化物的水溶液都是强酸 |
您最近半年使用:0次
2020-07-28更新
|
38次组卷
|
2卷引用:甘肃省白银市靖远县2019-2020学年高一下学期期末考试化学试题
名校
5 . 已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)X、Z两种元素的元素符号为X________ ,Z________ 。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________ 。
(3)①由X、Y、Z所形成的常见离子化合物是_________ (写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______ 。
③化合物WY3的晶体结构中含有的化学键为________ (选填序号)。
A 只含离子键 B 只含共价键 C 既含离子键又含共价键
(4)用电子式表示化合物W2Z的形成过程:___________ 。
(1)X、Z两种元素的元素符号为X
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为
(3)①由X、Y、Z所形成的常见离子化合物是
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为
③化合物WY3的晶体结构中含有的化学键为
A 只含离子键 B 只含共价键 C 既含离子键又含共价键
(4)用电子式表示化合物W2Z的形成过程:
您最近半年使用:0次
名校
6 . X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是( )
| A.X与Y形成的化合物只有一种 |
| B.R的氢化物的热稳定性比W的强 |
| C.原子半径:r(Z)<r(R) |
| D.Y的最高价氧化物的水化物的酸性比W的强 |
您最近半年使用:0次
2020-07-06更新
|
228次组卷
|
18卷引用:甘肃省高台县第一中学2020届高三上学期期中考试化学试题
甘肃省高台县第一中学2020届高三上学期期中考试化学试题(已下线)2012-2013学年江苏省宿迁市泗洪县洪翔中学高一下学期期中考化学卷(已下线)2013-2014学年江苏省沭阳县高一下学期期中调研测试化学试卷2015届江苏省南京市、盐城市高三第二次模拟考试化学试卷2014-2015江苏省宿迁市三校高一下学期4月月考化学试卷2016届江苏省无锡市青山高级中学高三上学期10月月考化学试卷2016届江苏省清江中学高三第四次(12月)月考化学试卷2016届江苏省常州市高三上学期期末考试化学试卷2015-2016学年四川省遂宁市射洪县射洪中学高一6月月考化学试卷2015-2016学年辽宁省沈阳铁路实验中学高一下期末理综化学试卷2015-2016学年青海省西宁市第五中学高二下学期期末考试化学试卷江苏省兴化市第一中学2016-2017学年高一下学期期末考试化学试题宁夏石嘴山市第三中学2016-2017学年高一下学期期末考试化学试题【全国百强校】湖南省师范大学附属中学2017-2018学年高二下学期期中考试化学试题江苏省锡山高级中学2019-2020学年高一下学期第一次阶段性检测化学试题宁夏吴忠市吴忠中学2019-2020学年高一学业水平文化课考试第一次模拟化学试题江苏省上冈高级中学2019-2020学年高二上学期期中考试化学(必修)试题江苏省泗洪县洪翔中学2020-2021学年高二上学期暑期学情调研化学(必修)试题
解题方法
7 . 现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是___ 。
(2)元素Y与氢元素形成一种离子YH ,写出该微粒的化学式:
,写出该微粒的化学式:___ (用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是___ (用元素符号表示),下列表述中能证明这一事实的是___ 。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是___ (填化学式),理由是_____ ;Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为___ 。
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(2)元素Y与氢元素形成一种离子YH
 ,写出该微粒的化学式:
,写出该微粒的化学式:(3)元素Z与元素T相比,非金属性较强的是
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是
您最近半年使用:0次
2020-07-02更新
|
43次组卷
|
2卷引用:甘肃省陇南市徽县二中2020-2021学年高一下学期第一次月考化学试题
名校
解题方法
8 . 现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示:
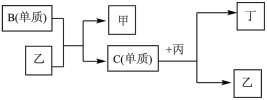
(1)写出B+乙→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________ 。(填写序号)
①A②B③C④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应
②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______ 周期第_______ 族;写出C+丙→乙+丁的化学反应方程式_______________________ 。

(1)写出B+乙→甲+C的化学反应方程式
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是
①A②B③C④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应
②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第
您最近半年使用:0次
2020-06-30更新
|
89次组卷
|
6卷引用:甘肃省兰州市第一中学2018届高三8月月考化学试题
名校
解题方法
9 . 短周期元素X和Y,可组成化合物X2Y3。当Y的原子序数为a时,X的原子序数可能是①a-3②a+5③a-8④a-1,其中正确的组合是
| A.①③④ | B.②③④ | C.①②③ | D.①②④ |
您最近半年使用:0次
名校
10 . 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。
(1)X、Y、Z、W、R均是1-18号元素,原子序数依次增大。X是所有元素中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R电子层数相同,R与Y最外层电子数相同,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相同。请回答下列问题:
①W的原子结构示意图__ ,R离子的电子式__ 。
②X与Y元素可形成一种常用的消毒剂,其结构式为_ 。
③Y、Z、W、R形成的简单离子半径由大到小顺序为__ (用化学符号表示)。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
①铷在元素周期表中的位置__ 。
②关于铷的下列说法中正确的是__ (填序号)。
a.与水反应比钠更剧烈
b.在空气中易吸收水和二氧化碳
c.Rb2O2与水能剧烈反应并释放出O2
d.单质具有很强的还原性
e.RbOH的碱性比同浓度的NaOH弱
(3)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:
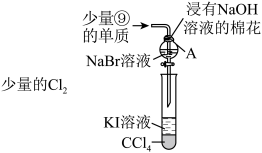
①棉花中浸有NaOH溶液的作用是__ (用离子方程式表示)
②验证溴与碘的非金属性强弱:通入少量氯气,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到__ ;该实验必须控制氯气的加入量,否则得不出溴的非金属性比碘强的结论,理由是__ 。
(1)X、Y、Z、W、R均是1-18号元素,原子序数依次增大。X是所有元素中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R电子层数相同,R与Y最外层电子数相同,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相同。请回答下列问题:
①W的原子结构示意图
②X与Y元素可形成一种常用的消毒剂,其结构式为
③Y、Z、W、R形成的简单离子半径由大到小顺序为
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
①铷在元素周期表中的位置
②关于铷的下列说法中正确的是
a.与水反应比钠更剧烈
b.在空气中易吸收水和二氧化碳
c.Rb2O2与水能剧烈反应并释放出O2
d.单质具有很强的还原性
e.RbOH的碱性比同浓度的NaOH弱
(3)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:

①棉花中浸有NaOH溶液的作用是
②验证溴与碘的非金属性强弱:通入少量氯气,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到
您最近半年使用:0次



