1 . 锗(Ge)原子结构示意图为: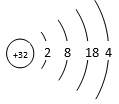
(1)锗位于元素周期表中的第_________ 周期,第________ 族,
(2)最高价氧化物化学式为________ ,对应水化物化学式为___________ 。
(3)根据示意图: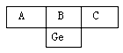
推得A、B、C依次为______ 、____ 、_____ 元素。A、B、C中,________ 是典型的非金属元素(填元素符号,下同),__________ 的最高价氧化物具有两性;可用作半导体的是_______ ,可作导体是________ ,常用来制农药的是__________ 。

(1)锗位于元素周期表中的第
(2)最高价氧化物化学式为
(3)根据示意图:

推得A、B、C依次为
您最近一年使用:0次
2 . 铁、铜、铬、镍及其化合物在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________ ,基态铁原子价电子排布式为___________ 。
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是______________ ,P、S元素第一电离能大小关系为_______________ 。
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为________ ;该配合物的熔点是170℃,则Ni(CO)n 属于 _______ 晶体。
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______ ,乙醇极易溶于水,其主要原因是_______________ 。
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为________ ,其晶胞边长为a cm,列式表示NiO晶体的密度为____ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。
(1)铁在元素周期表中的位置是
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为
您最近一年使用:0次
2017-07-01更新
|
482次组卷
|
2卷引用:四川省广安市2016-2017学年高二下学期期末考试化学试题
名校
3 . A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍.
(1)写出元素符号:A____ ,B____ ,C____ .
(2)画出D的离子结构示意图_________ .
(1)写出元素符号:A
(2)画出D的离子结构示意图
您最近一年使用:0次
2017-06-23更新
|
118次组卷
|
2卷引用:福建省清流县第一中学2016-2017学年高二下学期第三阶段考试化学试卷
名校
4 . 按要求填空。
(1)下列物质中属于同位素的是__________ ;属于同素异形体的是__________ 。
A.O2、O3 B.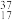 Cl和
Cl和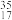 Cl
Cl
C.Fe2+、Fe3+ D.H2O、D2O、T2O
(2)据报道,某些花岗岩会产生放射性的稀有气体氡,从而对人体产生伤害,请将以下Rn的原子结构示意图补全。_______

(3)下列四种物质中①Ar,②CO2,③K2S,④NaOH,只有存在共价键的物质是___ ;(填编号)用电子式表示③的形成过程:__________ 。
(4)硅酸盐的组成比较复杂,常用氧化物的形式表示。石棉Mg3Ca(SiO3)4表示为氧化物形式为:__________ 。
(5)若K37ClO3+6H35C1===KCl+3Cl2↑+3H2O,则此反应中生成氯气的相对分子质量约为_________ (计算结果保留三位有效数字)。
(6)将NaHSO4溶于水,破坏了NaHSO4中的______ (填化学键类型),NaHSO4在熔融状态下电离,破坏了______ (填化学键类型),写出其在熔融状态下的电离方程式_____________ 。
(1)下列物质中属于同位素的是
A.O2、O3 B.
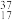 Cl和
Cl和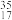 Cl
Cl C.Fe2+、Fe3+ D.H2O、D2O、T2O
(2)据报道,某些花岗岩会产生放射性的稀有气体氡,从而对人体产生伤害,请将以下Rn的原子结构示意图补全。

(3)下列四种物质中①Ar,②CO2,③K2S,④NaOH,只有存在共价键的物质是
(4)硅酸盐的组成比较复杂,常用氧化物的形式表示。石棉Mg3Ca(SiO3)4表示为氧化物形式为:
(5)若K37ClO3+6H35C1===KCl+3Cl2↑+3H2O,则此反应中生成氯气的相对分子质量约为
(6)将NaHSO4溶于水,破坏了NaHSO4中的
您最近一年使用:0次
5 . A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,另外五种元素均为短周期主族元素;②A、C原子p轨道的电子数分别为2和4;③D原子最外层电子数为偶数;④E原子价电子(外围电子)排布为msnmpn-1。请回答下列问题:
(1)下列叙述正确的是_____ (填序号)。
A.金属键的强弱:D>E B.基态原子第一电离能:D>E
C.六种元素中,电负性最大的元素是E D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为______ ;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为______ (填元素符号)。
(3)A与C形成的非极性分子,该分子与过量强碱反应生成的酸根离子的空间构型为_____ 。
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B3-中心原子的杂化轨道类型为____________ 。
①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,另外五种元素均为短周期主族元素;②A、C原子p轨道的电子数分别为2和4;③D原子最外层电子数为偶数;④E原子价电子(外围电子)排布为msnmpn-1。请回答下列问题:
(1)下列叙述正确的是
A.金属键的强弱:D>E B.基态原子第一电离能:D>E
C.六种元素中,电负性最大的元素是E D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为
(3)A与C形成的非极性分子,该分子与过量强碱反应生成的酸根离子的空间构型为
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B3-中心原子的杂化轨道类型为
您最近一年使用:0次
6 . 电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:2NaOCN+3NaClO→Na2CO3+CO2↑+3NaCl+N2↑
完成下列填空:
(1)上述反应涉及的元素中,氮原子核外价电子数是______ 个;
O2—、Na+、Cl—中半径最小的是_____________ 。
(2)NaCN晶体中含有的化学键类型为_____________________________ 。
(3)第二段过程中,产物属于双原子分子的结构式是___________ ,该物质一般要比其他共价化合物如:NH3、H2S等都要稳定,其原因为:___________________ ;写出该物质的一种用途:____________________ 。
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:2NaOCN+3NaClO→Na2CO3+CO2↑+3NaCl+N2↑
完成下列填空:
(1)上述反应涉及的元素中,氮原子核外价电子数是
O2—、Na+、Cl—中半径最小的是
(2)NaCN晶体中含有的化学键类型为
(3)第二段过程中,产物属于双原子分子的结构式是
您最近一年使用:0次
7 . (1)某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小 的,其核外电子排布式为______ ,价电子构型为______ ,属________ 区元素。
(2)某元素原子的价电子构型为4s24p1,它属于第________ 周期________ 族,最高正化合价为________ ,元素符号是________ 。
(3)原子序数为24的元素原子中有________ 个电子层,________ 个能级,________ 个未成对电子。
(4)请写出有2个能层的p轨道中只有一个未成对电子的基态原子的外围电子排布图(有几个写几个)________________ 。
(2)某元素原子的价电子构型为4s24p1,它属于第
(3)原子序数为24的元素原子中有
(4)请写出有2个能层的p轨道中只有一个未成对电子的基态原子的外围电子排布图(有几个写几个)
您最近一年使用:0次
8 . 铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____ 区。基态Al原子的L层电子排布图为___________ 。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________ ,1mol乙酸分子中含有的σ键的数目为____________ 。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____ 。碳、硼、氮元素的电负性由大到小的顺序是_____ 。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________ 。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____ g·cm-3(设阿伏伽德罗常数的值为NA)。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为
您最近一年使用:0次
9 . 以下元素均为短周期元素:
(1)B在周期表中的位置______ ,C离子的结构示意图_______ 。
(2)D的最低价含氧酸的电子式______ 。
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式____ 。(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:______ 。
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为___________ 。
元素代号 | 相关信息 |
M | 非金属元素,其气态氢化物的水溶液呈碱性 |
A | A的单质与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是内层电子数的三倍 |
C | 在第三周期中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)B在周期表中的位置
(2)D的最低价含氧酸的电子式
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为
您最近一年使用:0次
10 . 有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置__________ ;E元素价电子排布式为__________ 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是______ (写分子式)。
(3)B与D形成的非极性分子的电子式为________ 。
(4)B、C、D三种元素的第一电离能由大到小的顺序是_____ (用元素符号表示)。
(5)C的单质分子中σ键和π键的个数比为________ 。
(6)已知在25℃、101kPa下:ABC(aq)+A2D(l)=BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(l)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示):_______ 。
(1)E元素在周期表中的位置
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是
(3)B与D形成的非极性分子的电子式为
(4)B、C、D三种元素的第一电离能由大到小的顺序是
(5)C的单质分子中σ键和π键的个数比为
(6)已知在25℃、101kPa下:ABC(aq)+A2D(l)=BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(l)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示):
您最近一年使用:0次



