解题方法
1 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关徼粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为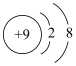 |
C.O的电子式: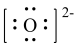 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近一年使用:0次
解题方法
2 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
名校
解题方法
3 . 下列叙述中正确的是
| A.含离子键的化合物一定是离子化合物 |
| B.含共价键的化合物一定是共价化合物 |
| C.全部由非金属元䋈组成的化合物一定是共价化合物 |
| D.在离子化合物中不可能有共价键 |
您最近一年使用:0次
名校
解题方法
4 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ. 可用作储存氢气的材料,结构如下图所示。
可用作储存氢气的材料,结构如下图所示。
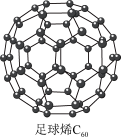
(1)继 后,科学家合成了
后,科学家合成了 、
、 ,三者结构相似。下列说法正确的是
,三者结构相似。下列说法正确的是_______ (填序号)
A. 、
、 、
、 都属于共价晶体
都属于共价晶体
B.由于N-N键能小于 ,故
,故 的稳定性弱于
的稳定性弱于
C.由于C-C键长小于Si-Si键,所以 熔沸点低于
熔沸点低于
Ⅱ.是储氢材料,已知其由 和
和 构成,释放氢气的原理为
构成,释放氢气的原理为 。
。
(2) 中不存在的作用力有
中不存在的作用力有___________ (填序号)。
A.离子键 B.共价键 C.分子间作用力
(3)氢化锂(LiH)是离子化合物,写出其电子式___________ ,LiH中离子半径较大的是___________ ,其原因是___________ 。
Ⅲ.汽车安全气囊中的填充物有 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和氮气。完成下列填空:
遇撞击时能生成金属钠和氮气。完成下列填空:
(4)写出 的电子式:
的电子式:___________ 。
(5) 和
和 是两种不同的化合物,
是两种不同的化合物, 是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。 晶体中存在的化学键类型有
晶体中存在的化学键类型有___________ , 遇
遇 会水解而产生
会水解而产生 和
和 ,
, 晶体中存在的化学键类型有
晶体中存在的化学键类型有___________ 。
(6)汽车安全气囊填充物的三种物质中属于共价化合物的是___________ (填写化学式),所涉及的5种元素中,原子半径最大的是___________ (填写元素符号)。
(7)该题中出现的极性分子有___________ 。
(8)渗氮工艺已经成为钢材处理的重要手段,已知一种磁性氮化铁晶胞如下图,该物质的化学式是___________ 。

Ⅰ.
 可用作储存氢气的材料,结构如下图所示。
可用作储存氢气的材料,结构如下图所示。
(1)继
 后,科学家合成了
后,科学家合成了 、
、 ,三者结构相似。下列说法正确的是
,三者结构相似。下列说法正确的是A.
 、
、 、
、 都属于共价晶体
都属于共价晶体B.由于N-N键能小于
 ,故
,故 的稳定性弱于
的稳定性弱于
C.由于C-C键长小于Si-Si键,所以
 熔沸点低于
熔沸点低于
Ⅱ.是储氢材料,已知其由
 和
和 构成,释放氢气的原理为
构成,释放氢气的原理为 。
。(2)
 中不存在的作用力有
中不存在的作用力有A.离子键 B.共价键 C.分子间作用力
(3)氢化锂(LiH)是离子化合物,写出其电子式
Ⅲ.汽车安全气囊中的填充物有
 (叠氮酸钠)、
(叠氮酸钠)、 、
、 等物质,
等物质, 遇撞击时能生成金属钠和氮气。完成下列填空:
遇撞击时能生成金属钠和氮气。完成下列填空:(4)写出
 的电子式:
的电子式:(5)
 和
和 是两种不同的化合物,
是两种不同的化合物, 是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。
是由一种单原子离子和一种多原子离子以1:1的比例构成的化合物。 晶体中存在的化学键类型有
晶体中存在的化学键类型有 遇
遇 会水解而产生
会水解而产生 和
和 ,
, 晶体中存在的化学键类型有
晶体中存在的化学键类型有(6)汽车安全气囊填充物的三种物质中属于共价化合物的是
(7)该题中出现的极性分子有
(8)渗氮工艺已经成为钢材处理的重要手段,已知一种磁性氮化铁晶胞如下图,该物质的化学式是

您最近一年使用:0次
名校
解题方法
5 . 汽车是现代社会重要的交通工具之一,化学物质在汽车的动力、安全等方面有着极为重要的作用。
Ⅰ.氨气是制备NaN3(叠氮化钠)的原料之一,汽车安全气囊中的填充物有NaN3、SiO2、KNO3等物质,NaN3遇撞击时能生成金属钠和N2。
(1)上述列举的三种汽车安全气囊填充物中属于共价化合物的是___________ (填化学式),所涉及的5种元素中,非金属元素的原子半径由大到小的顺序为___________ 。
(2)请列举一个事实说明N元素与O元素的非金属性强弱___________ 。
(3)下列有关化学用语表示正确的是___________。
(4) 的空间构型为___________。
的空间构型为___________。
Ⅱ.NaN3是由一种单原子离子和多原子离子以1:1的比例构成的化合物。
(5)叠氮化钠固体中所含化学键的类型为___________ ,叠氮化钠的晶体类型为___________ 。
(6)写出叠氮化钠分解的化学方程式___________ 。
(7)工业通过反应一:
反应二:
制备NaN3,下列有关说法中正确的是___________(双选)。
Ⅰ.氨气是制备NaN3(叠氮化钠)的原料之一,汽车安全气囊中的填充物有NaN3、SiO2、KNO3等物质,NaN3遇撞击时能生成金属钠和N2。
(1)上述列举的三种汽车安全气囊填充物中属于共价化合物的是
(2)请列举一个事实说明N元素与O元素的非金属性强弱
(3)下列有关化学用语表示正确的是___________。
A.Ne和N3-的结构示意图均为 | B.二氧化硅的分子式:SiO2 |
C.氨气的空间填充模型: | D.NH4Br的电子式: |
 的空间构型为___________。
的空间构型为___________。| A.平面三角形 | B.三角锥形 | C.四面体形 | D.直线形 |
Ⅱ.NaN3是由一种单原子离子和多原子离子以1:1的比例构成的化合物。
(5)叠氮化钠固体中所含化学键的类型为
(6)写出叠氮化钠分解的化学方程式
(7)工业通过反应一:

反应二:

制备NaN3,下列有关说法中正确的是___________(双选)。
| A.反应一每生成5.6L氢气(已换算至标准状况下的体积),转移电子数目为NA |
| B.反应一中NaNH2为强电解质,NH3为弱电解质 |
| C.反应二中生成的氨气可以循环利用 |
| D.与NaN3同为碱金属叠氮化物的LiN3受撞击分解产生Li3N和氮气,反应过程中发生了离子键和共价键的破坏与形成 |
您最近一年使用:0次
名校
解题方法
6 . 能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,水分解断裂的化学键是_______ (填“离子键”或“共价键”)。
(2)下列化学反应在理论上可以设计成原电池的是_______(填字母)。
(3)如图为某燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。回答下列问题:

若该燃料电池为氢氧燃料电池。
①a极通入的物质为_______ (填物质名称),电解质溶液中的OH-移向_______ (“负”或“正”)。
②写出此氢氧燃料电池工作时总反应方程式:_______ 。
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,水分解断裂的化学键是
(2)下列化学反应在理论上可以设计成原电池的是_______(填字母)。
A.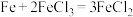 | B. |
C. | D.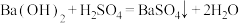 |

若该燃料电池为氢氧燃料电池。
①a极通入的物质为
②写出此氢氧燃料电池工作时总反应方程式:
您最近一年使用:0次
名校
解题方法
7 . A、B、C、D、E、F为短周期元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。

回答下列问题:
(1)F离子结构示意图为_______ ;化合物EF2的化学式为_______ 。
(2)从原子结构角度解释A金属性强于B的原因:_______ 。
(3)CE2属于易燃易爆液体,严禁旅客携带,则CE2的结构式为_______ ,写出CE2在足量O2中燃烧的化学方程式_______ 。
(4)化合物AD3常用于安全气囊,该化合物含有的化学键类型有_______ (填“离子键”、“极性键”或“非极性键”)。
(5)在硝酸工业中,D的氢化物能发生催化氧化反应,写出该反应的化学方程式为_______ 。

回答下列问题:
(1)F离子结构示意图为
(2)从原子结构角度解释A金属性强于B的原因:
(3)CE2属于易燃易爆液体,严禁旅客携带,则CE2的结构式为
(4)化合物AD3常用于安全气囊,该化合物含有的化学键类型有
(5)在硝酸工业中,D的氢化物能发生催化氧化反应,写出该反应的化学方程式为
您最近一年使用:0次
名校
8 . 某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
步骤1:打开 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。

(1)装置②中的试剂是______ ,装置③中的试剂是______
A.饱和 溶液 B.饱和
溶液 B.饱和 溶液 C.浓
溶液 C.浓
步骤1和步骤2中,a处带火星的木条产生的实验现象分别是______ ;______ 。
(2)甲同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟 发生了化学反应。”
发生了化学反应。”
①其理由是___________________________ 。
②两瓶无色溶液分别为 溶液和盐酸溶液,将
溶液和盐酸溶液,将_______ 逐滴加入______ 中,至过量,一开始没有现象,之后出现______ (填现象),请写出相关的离子反应方程式____________________
(3)为了解决甲同学的质疑,需补充的实验操作是:取⑤中反应后的少量固体,______ 。
(4)过氧化物在纺织业工业里有重要的作用,关于 的说法正确的是
的说法正确的是
步骤1:打开
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。步骤2:打开
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(1)装置②中的试剂是
A.饱和
 溶液 B.饱和
溶液 B.饱和 溶液 C.浓
溶液 C.浓
步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(2)甲同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟
 发生了化学反应。”
发生了化学反应。”①其理由是
②两瓶无色溶液分别为
 溶液和盐酸溶液,将
溶液和盐酸溶液,将(3)为了解决甲同学的质疑,需补充的实验操作是:取⑤中反应后的少量固体,
(4)过氧化物在纺织业工业里有重要的作用,关于
 的说法正确的是
的说法正确的是| A.负离子的电子数为10 | B.正负离子个数比1:1 |
| C.属于离子化合物 | D.只含有离子键 |
您最近一年使用:0次
名校
9 . 人类对原子结构的探索为科技发展带来了卓越贡献,门捷列夫发现的元素周期律也为研究物质性质,合成新的物质做出了重要的指导作用。
(1)工业焊接钢管时常用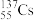 进行“无损探伤”,该原子___________
进行“无损探伤”,该原子___________
(2)下列变化中破坏共价键的是___________
(1)工业焊接钢管时常用
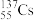 进行“无损探伤”,该原子___________
进行“无损探伤”,该原子___________| A.质子数是82 | B.中子数是55 | C.与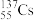 互为同位素 互为同位素 | D.摩尔质量是137 |
| A.冰融化 | B.NaOH融化 | C.HCl溶于水 | D.干冰升华 |
您最近一年使用:0次
21-22高一下·上海浦东新·期中
名校
解题方法
10 . 含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。某兴趣小组从 和
和 的混合物分离出
的混合物分离出 ,流程图如下:
,流程图如下:
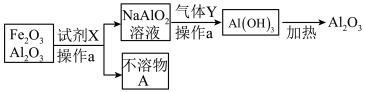
(1)操作a的名称为___________ ;需要的玻璃仪器有烧杯、___________ 。
(2)写出下列物质的化学式:试剂X___________ ;不溶物A___________ ;
(3)气体Y的结构式为___________ ;若通入的Y是足量的,则发生的反应方程式为___________ 。
(4)电解熔融的 可以制备铝单质,而不能通过电解熔融的
可以制备铝单质,而不能通过电解熔融的 来生产铝,原因是
来生产铝,原因是___________ 。
(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为: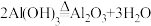 ,根据方程式解释氢氧化铝能做阻燃剂的原因:
,根据方程式解释氢氧化铝能做阻燃剂的原因:___________ 。
 和
和 的混合物分离出
的混合物分离出 ,流程图如下:
,流程图如下:
(1)操作a的名称为
(2)写出下列物质的化学式:试剂X
(3)气体Y的结构式为
(4)电解熔融的
 可以制备铝单质,而不能通过电解熔融的
可以制备铝单质,而不能通过电解熔融的 来生产铝,原因是
来生产铝,原因是(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为:
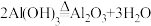 ,根据方程式解释氢氧化铝能做阻燃剂的原因:
,根据方程式解释氢氧化铝能做阻燃剂的原因:
您最近一年使用:0次



