名校
解题方法
1 . 元素X、Y、Z、W均属前4周期,基态X原子的2p轨道中成对电子与未成对电子相等;Y是地壳含量最多的金属元素;Z的单质常温下是黄绿色气体;基态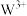 的3d轨道为半充满。下列说法正确的是
的3d轨道为半充满。下列说法正确的是
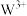 的3d轨道为半充满。下列说法正确的是
的3d轨道为半充满。下列说法正确的是
A.简单离子半径: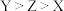 |
B.简单氢化物沸点: |
| C.Y与Z形成的化合物是电解质,熔融状态能导电 |
D. 晶胞的 晶胞的 结构如图所示, 结构如图所示,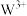 已标出, 已标出,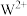 应位于c处 应位于c处 |
您最近一年使用:0次
解题方法
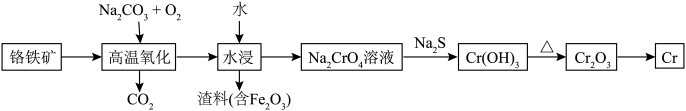
2 . 铬用于制不锈钢、汽车零件、工具、磁带和录像带等,铬铁矿炼铬过程中部分物质之间的转化关系如图。 原子的价电子排布式为
原子的价电子排布式为___________ ,最高能层上的电子占据的原子轨道轮廓图为___________ 形。
(2)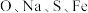 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是___________ 。
(3) 的立体构型为
的立体构型为___________ 形,其中C的杂化轨道类型为___________ 。
(4)K和 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为___________ 。
(5)将 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
写出浅绿色晶体配合物的化学式:___________ 。
(6) 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表___________ (填“ ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为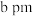 ,
, ,
,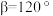 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 原子的价电子排布式为
原子的价电子排布式为(2)
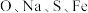 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是(3)
 的立体构型为
的立体构型为(4)K和
 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为(5)将
 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。| 晶体颜色 | 深绿色 | 浅绿色 | 紫色 |
 沉淀的物质的量/ 沉淀的物质的量/ | 1 | 2 | 3 |
(6)
 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表 ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为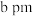 ,
, ,
,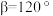 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为 (列出计算式即可)。
(列出计算式即可)。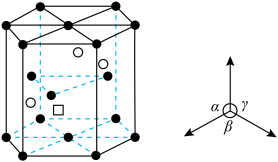
您最近一年使用:0次
名校
解题方法
3 . 氮及其化合物应用广泛。回答下列问题:
(1)基态N原子处于最高能级的电子云轮廓图为________ ,能量最低的激发态N3-的核外电子排布式为_________ 。
(2)胍(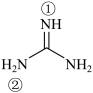 )为平面形分子,N原子的杂化轨道方式为
)为平面形分子,N原子的杂化轨道方式为___________ ,分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则胍分子中存在的大π键可表示为
),则胍分子中存在的大π键可表示为___________ 。胍属于___________ 分子(填“极性”或“非极性”),①号N原子 键角
键角___________ ②号N原子 键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是
键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是___________ 。
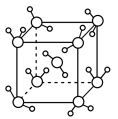
(3)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。则该晶体中H2O的配位数为___________ 。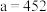 pm,
pm,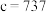 pm,
pm,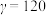 标注为1、2、3的氧原子在Z轴的分数坐标分别为:
标注为1、2、3的氧原子在Z轴的分数坐标分别为: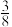 、
、 、
、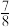 。
。___________ pm。(保留一位小数)
②普通冰晶体的密度为___________ g·cm-3(列出数学表达式,不必计算出结果)。
(1)基态N原子处于最高能级的电子云轮廓图为
(2)胍(
 )为平面形分子,N原子的杂化轨道方式为
)为平面形分子,N原子的杂化轨道方式为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则胍分子中存在的大π键可表示为
),则胍分子中存在的大π键可表示为 键角
键角 键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是
键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是(3)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。则该晶体中H2O的配位数为
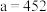 pm,
pm,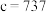 pm,
pm,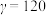 标注为1、2、3的氧原子在Z轴的分数坐标分别为:
标注为1、2、3的氧原子在Z轴的分数坐标分别为: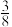 、
、 、
、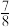 。
。
②普通冰晶体的密度为
您最近一年使用:0次
解题方法
4 . 氯化铵焙烧菱锰矿 (主要成分为  , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
②常温下, 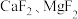 的溶度积分别为
的溶度积分别为 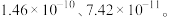
回答下列问题:
(1)基态锰原子的电子排布式为______ ,  的空间结构为
的空间结构为_______ 。
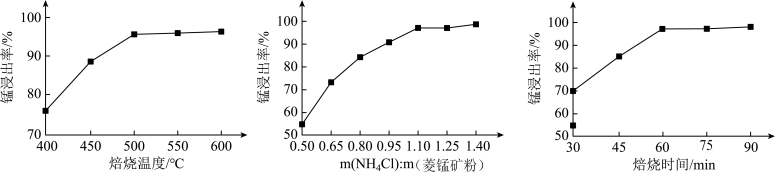
(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是_______ 。
(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的_______ (填化学式)。
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为_______ ; 若溶液中金属离子浓度均为0.1 mol·L-1,调节溶液pH使 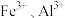 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为_______ ,再加入NH4F 沉淀Ca²⁺、Mg²⁺,_______ ,当 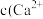 +
+  时,
时,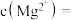
_______ 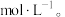
(5)碳化结晶时,发生反应的离子方程式为_______ 。
(6)流程中能循环利用的固态物质是_______ (填化学式)。
 , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下: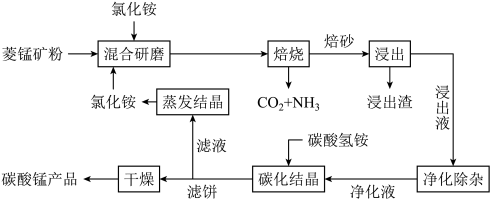
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的 pH | 3.8 | 1.5 | 6.5 | 10.6 | 8.1 | 9.6 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 12.6 | 10.1 | 11.6 |
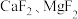 的溶度积分别为
的溶度积分别为 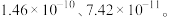
回答下列问题:
(1)基态锰原子的电子排布式为
 的空间结构为
的空间结构为(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是

(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为
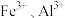 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为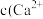 +
+  时,
时,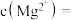
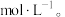
(5)碳化结晶时,发生反应的离子方程式为
(6)流程中能循环利用的固态物质是
您最近一年使用:0次
5 . 氮、砷及其化合物在工农业生产等方面有着重要应用。回答下列问题:
(1)氮氧化物( )是常见的大气污染气体之一,用
)是常见的大气污染气体之一,用 催化还原
催化还原 可消除氮氧化物的污染。
可消除氮氧化物的污染。
已知:
①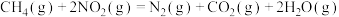
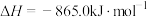 ;
;
②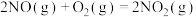
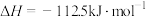 ;
;
③适量的 和
和 完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
则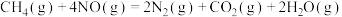

___________  。
。
(2)基态砷原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为___________ 。(已知:d轨道电子云轮廓图呈花瓣形。)
(3)在恒容密闭容器中,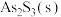 分解反应:
分解反应: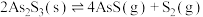 达平衡时,气体总压的对数值
达平衡时,气体总压的对数值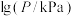 与温度的关系如图1所示。
与温度的关系如图1所示。___________ (填“增大”“减小”或“不变”)。
②A点对应温度下的
___________ 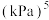 (用分数表示)。
(用分数表示)。
(4)25℃时,向0.1 三元弱酸
三元弱酸 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 、
、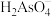 、
、 及
及 的物质的量分布分数随pH的变化如图2所示。
的物质的量分布分数随pH的变化如图2所示。___________ 。
②反应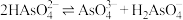 的平衡常数
的平衡常数
___________ 。
(5)某原电池装置如图3所示,电池总反应为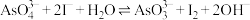 。当P池中溶液由无色变蓝色时,正极上的电极反应式为
。当P池中溶液由无色变蓝色时,正极上的电极反应式为___________ ;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___________ 。
(1)氮氧化物(
 )是常见的大气污染气体之一,用
)是常见的大气污染气体之一,用 催化还原
催化还原 可消除氮氧化物的污染。
可消除氮氧化物的污染。已知:
①
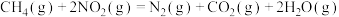
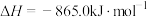 ;
;②
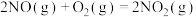
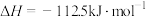 ;
;③适量的
 和
和 完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。则
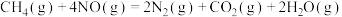

 。
。(2)基态砷原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为
(3)在恒容密闭容器中,
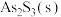 分解反应:
分解反应: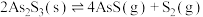 达平衡时,气体总压的对数值
达平衡时,气体总压的对数值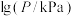 与温度的关系如图1所示。
与温度的关系如图1所示。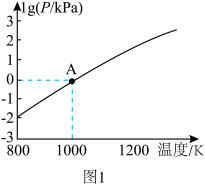
②A点对应温度下的

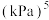 (用分数表示)。
(用分数表示)。(4)25℃时,向0.1
 三元弱酸
三元弱酸 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 、
、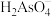 、
、 及
及 的物质的量分布分数随pH的变化如图2所示。
的物质的量分布分数随pH的变化如图2所示。
②反应
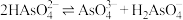 的平衡常数
的平衡常数
(5)某原电池装置如图3所示,电池总反应为
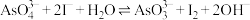 。当P池中溶液由无色变蓝色时,正极上的电极反应式为
。当P池中溶液由无色变蓝色时,正极上的电极反应式为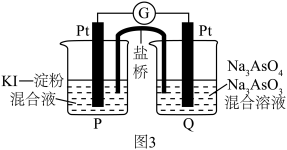
您最近一年使用:0次
6 . 用 表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是
 表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是A.1mol 含有π键的数目为 含有π键的数目为 |
B.1mol基态Cr原子的未成对电子数为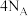 |
C.46g 和 和 的混合气体含有的原子数为 的混合气体含有的原子数为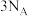 |
D.2.24L(标准状况)乙醇与足量Na充分反应,生成 的分子数为 的分子数为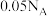 |
您最近一年使用:0次
7 . 下列化学用语的表达正确的是
A.在氨水中 与 与 分子间的氢键主要形式可表示为: 分子间的氢键主要形式可表示为: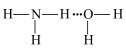 |
B.基态Sc原子的核外电子排布式: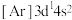 |
C.用电子式表示 形成: 形成: |
D.用轨道表示式表示石墨烯中C原子的杂化: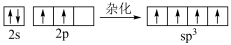 |
您最近一年使用:0次
名校
8 . 化合物 是一种化学药物合成的重要中间体。
是一种化学药物合成的重要中间体。 的一种合成路线如图所示。
的一种合成路线如图所示。
(1)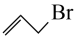 中基态
中基态 原子的核外电子排布式为
原子的核外电子排布式为
_______ 。
(2)有机物 的结构简式为
的结构简式为_______ , 的反应类型为
的反应类型为_______ 。
(3) 的化学方程式为
的化学方程式为_______ 。
(4)有机物 是
是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 有
有_______ 种(不考虑立体异构);
①分子中除苯环外不含其他环状结构
②仅含有一种官能团,能与新制 反应生成砖红色沉淀
反应生成砖红色沉淀
③苯环上有3个取代基
其中核磁共振氢谱显示为5组峰,且峰面积之比为 的同分异构体的结构简式为
的同分异构体的结构简式为_______ (写出一种即可)。
(5)设计以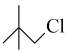 和
和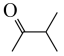 为原料制备
为原料制备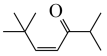 的合成路线:
的合成路线:_______ 。
 是一种化学药物合成的重要中间体。
是一种化学药物合成的重要中间体。 的一种合成路线如图所示。
的一种合成路线如图所示。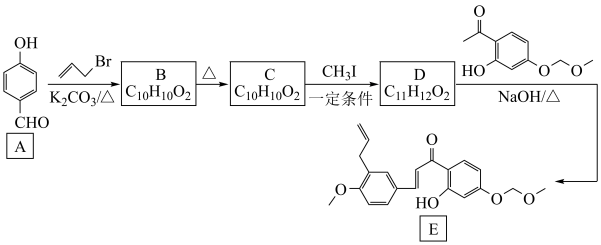
已知:Ⅰ.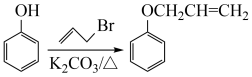

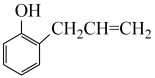 。
。
Ⅱ.R1-CHO+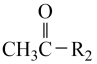

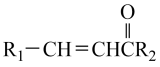 。
。
(1)
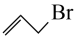 中基态
中基态 原子的核外电子排布式为
原子的核外电子排布式为
(2)有机物
 的结构简式为
的结构简式为 的反应类型为
的反应类型为(3)
 的化学方程式为
的化学方程式为(4)有机物
 是
是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 有
有①分子中除苯环外不含其他环状结构
②仅含有一种官能团,能与新制
 反应生成砖红色沉淀
反应生成砖红色沉淀③苯环上有3个取代基
其中核磁共振氢谱显示为5组峰,且峰面积之比为
 的同分异构体的结构简式为
的同分异构体的结构简式为(5)设计以
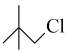 和
和 为原料制备
为原料制备 的合成路线:
的合成路线:
您最近一年使用:0次
9 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
2024·上海·模拟预测
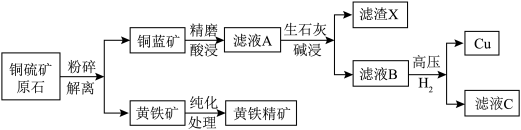
10 . 某铜硫矿富含黄铁矿和磁黄铁矿等硫铁矿物,占原矿矿物总量38%,实验室以此为原料模拟工业制备纯铜并利用黄铁精矿进行含铬废水处理,工艺流程转化如下:
2.铜蓝矿的主要成分为CuS,黄铁矿的主要成分为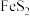 。
。
3.可能用到的数据如下:
(1)基态铜原子的空间运动状态为___________ 种。
(2)精磨酸浸过程中,精磨的作用是___________ ;酸浸一般选用硫酸溶液在纯氧环境中进行,酸浸的化学方程式为___________ 。
(3)已知增大氧气的浓度可以提高 的浸取率,请结合化学用语解释其原因
的浸取率,请结合化学用语解释其原因___________ 。
(4)生石灰碱浸时调节pH的范围为___________。
(5)滤渣X的主要成分是___________ 。
(6)向滤液B中通入高压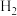 ,可成功制得单质铜的原因是
,可成功制得单质铜的原因是___________ 。
(7)黄铁精矿处理含铬废水的机理如图所示: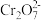 )发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
)发生氧化还原反应,请结合信息写出此过程的离子反应方程式:___________ 。
2.铜蓝矿的主要成分为CuS,黄铁矿的主要成分为
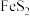 。
。3.可能用到的数据如下:
 |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(2)精磨酸浸过程中,精磨的作用是
(3)已知增大氧气的浓度可以提高
 的浸取率,请结合化学用语解释其原因
的浸取率,请结合化学用语解释其原因(4)生石灰碱浸时调节pH的范围为___________。
| A.3.2≤pH<4.7 | B.3.2≤pH<6.1 | C.4.2≤pH<6.7 | D.3.2≤pH<4.2 |
(6)向滤液B中通入高压
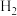 ,可成功制得单质铜的原因是
,可成功制得单质铜的原因是(7)黄铁精矿处理含铬废水的机理如图所示:
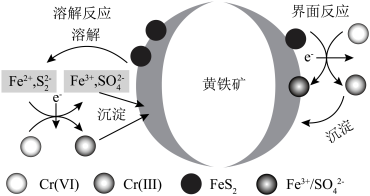
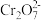 )发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
)发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
您最近一年使用:0次



