解题方法
1 . 硒(Se)和碲(Te)均为硫(S)的同族元素,原子序数分别为34、52,它们的单质和化合物在电子、冶金、材料等领域有广阔的发展前景。科研小组以精炼铜的阳极泥为原料(含有 、
、 、
、 和少量金属单质Ag)回收Se、Te并制备胆矾的一种流程如图:
和少量金属单质Ag)回收Se、Te并制备胆矾的一种流程如图:

回答下列问题:
(1)Cu原子的价电子排布式为_______ ; 属于
属于_______ (填“酸性”“碱性”或“两性”)氧化物。
(2) 的稳定性比
的稳定性比 的
的_______ (填“强”或“弱”); ,
, ,
, 的沸点由高到低为
的沸点由高到低为_______ 。
(3)“水溶”反应的离子方程式为_______ 。
(4)“碱溶”的目的为_______ 。
(5)“分离”过程需控制适当温度,不宜过高或过低的理由为_______ 。
(6)若滤液2的 ,其中
,其中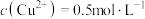 、
、 、
、 ,则滤渣Ⅱ的成分为
,则滤渣Ⅱ的成分为_______ 。[已知 、
、 ]
]
(7)用滤液2制备 的操作为
的操作为_______ 。
 、
、 、
、 和少量金属单质Ag)回收Se、Te并制备胆矾的一种流程如图:
和少量金属单质Ag)回收Se、Te并制备胆矾的一种流程如图:
回答下列问题:
(1)Cu原子的价电子排布式为
 属于
属于(2)
 的稳定性比
的稳定性比 的
的 ,
, ,
, 的沸点由高到低为
的沸点由高到低为(3)“水溶”反应的离子方程式为
(4)“碱溶”的目的为
(5)“分离”过程需控制适当温度,不宜过高或过低的理由为
(6)若滤液2的
 ,其中
,其中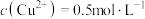 、
、 、
、 ,则滤渣Ⅱ的成分为
,则滤渣Ⅱ的成分为 、
、 ]
](7)用滤液2制备
 的操作为
的操作为
您最近一年使用:0次
名校
解题方法
2 . 镍、镍合金及其化合物用途广泛。回答下列问题:
(1)基态Fe3+与Ni2+离子中未成对电子数之比为___________ 。
(2)Ni-NTA-Nangold可用于检测或定位6x组氨酸(His)或Poly-His标记的重组蛋白。Ni(Ⅱ)- NTA的结构简式如下:

①配合物中向Ni2+提供电子对的原子是________ 。
②配体N(CH2COO-)3中4种元素的电负性从大到小顺序为_______ 。三乙酸胺[N(CH2COOH)3]与三正丁胺[N(CH2CH2CH2CH3)3]的相对分子质量相近,但三乙酸胺的熔点(167℃)、沸点(246℃)分别高于三正丁胺的熔点(-70℃)、沸点(216.5℃),原因是_______ 。
(3)铁磁DMS被认为是自选电子应用的关键和可行材料。镍参杂的稀磁半导体的立方晶胞如下图:晶胞中含有Mg原子______ 个。

(4)胆矾的结构如图所示。下列说法正确的是________。

(1)基态Fe3+与Ni2+离子中未成对电子数之比为
(2)Ni-NTA-Nangold可用于检测或定位6x组氨酸(His)或Poly-His标记的重组蛋白。Ni(Ⅱ)- NTA的结构简式如下:

①配合物中向Ni2+提供电子对的原子是
②配体N(CH2COO-)3中4种元素的电负性从大到小顺序为
(3)铁磁DMS被认为是自选电子应用的关键和可行材料。镍参杂的稀磁半导体的立方晶胞如下图:晶胞中含有Mg原子

(4)胆矾的结构如图所示。下列说法正确的是________。

| A.胆矾晶体中含有离子键、配位键、氢键等化学键 | B.胆矾属于离子晶体 |
C. 的空间结构为正四面体形 的空间结构为正四面体形 | D.电负性O>S,第一电离能 |
您最近一年使用:0次
2024-02-16更新
|
262次组卷
|
2卷引用:江苏省阜宁中学2023-2024学年高二上学期期末化学试卷
名校
解题方法
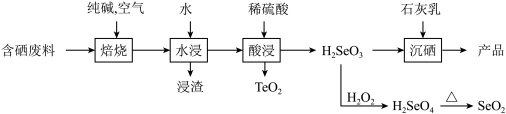
3 . 硒被誉为“生命元素”。亚硒酸钙(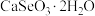 ,难溶于水)常用作饲料添加剂,
,难溶于水)常用作饲料添加剂, 常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是
常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是 和
和 )制备亚硒酸钙和二氧化硒的工艺流程如下。
)制备亚硒酸钙和二氧化硒的工艺流程如下。
回答下列问题:
(1)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部充入,这样操作的目的是_______ ;“焙烧”中固体产物为 和
和 ,“焙烧”时
,“焙烧”时 反应的化学方程式为
反应的化学方程式为_______ 。
(2)水浸时浸渣的主要成分是_______ (填化学式)。
(3)“沉硒”的化学方程式为________ 。
(4)基态 原子核外电子排布式为
原子核外电子排布式为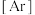
_______ 。
(5)已知 熔点为
熔点为 ,
, 时升华,则
时升华,则 形成的晶体类型为
形成的晶体类型为______ 。
(6)测定 产品纯度。
产品纯度。
称取 产品溶于水,加入足量
产品溶于水,加入足量 溶液和适量稀盐酸,充分反应后,用
溶液和适量稀盐酸,充分反应后,用 标准溶液滴定至终点时消耗
标准溶液滴定至终点时消耗 滴定液。
滴定液。
发生有关反应:① (未配平);
(未配平);
② 。
。
在下列试剂中,宜选择的指示剂为_____ (填标号)。 产品中
产品中 的质量分数为
的质量分数为______  。
。
A. 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液
C. 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液
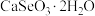 ,难溶于水)常用作饲料添加剂,
,难溶于水)常用作饲料添加剂, 常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是
常用作制备含硒营养物质的原料。一种利用含硒废料(主要成分是 和
和 )制备亚硒酸钙和二氧化硒的工艺流程如下。
)制备亚硒酸钙和二氧化硒的工艺流程如下。
回答下列问题:
(1)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部充入,这样操作的目的是
 和
和 ,“焙烧”时
,“焙烧”时 反应的化学方程式为
反应的化学方程式为(2)水浸时浸渣的主要成分是
(3)“沉硒”的化学方程式为
(4)基态
 原子核外电子排布式为
原子核外电子排布式为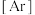
(5)已知
 熔点为
熔点为 ,
, 时升华,则
时升华,则 形成的晶体类型为
形成的晶体类型为(6)测定
 产品纯度。
产品纯度。称取
 产品溶于水,加入足量
产品溶于水,加入足量 溶液和适量稀盐酸,充分反应后,用
溶液和适量稀盐酸,充分反应后,用 标准溶液滴定至终点时消耗
标准溶液滴定至终点时消耗 滴定液。
滴定液。发生有关反应:①
 (未配平);
(未配平);②
 。
。在下列试剂中,宜选择的指示剂为
 产品中
产品中 的质量分数为
的质量分数为 。
。A.
 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液C.
 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液
您最近一年使用:0次
2024-02-13更新
|
155次组卷
|
2卷引用:河北省石家庄市新乐市第一中学等校2023-2024学年高三上学期省级联测考试化学试卷
解题方法
4 . 钛白粉学名二氧化钛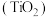 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
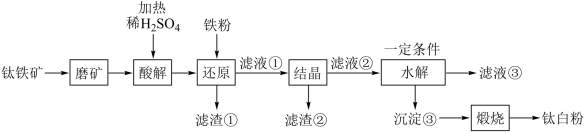
已知:①酸解后,钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
② 不溶于水和稀酸。
不溶于水和稀酸。
(1)写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
(2)磨矿的目的是___________ 。
(3)滤渣①的主要成分是___________ 。
(4)酸解过程中,写出 发生反应的化学方程式
发生反应的化学方程式___________ 。
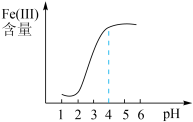
(5)还原过程中,加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:___________ 。
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为___________ 。
②一定量 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理___________ 。
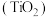 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以
 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。②
 不溶于水和稀酸。
不溶于水和稀酸。(1)写出基态
 原子的价层电子排布式
原子的价层电子排布式(2)磨矿的目的是
(3)滤渣①的主要成分是
(4)酸解过程中,写出
 发生反应的化学方程式
发生反应的化学方程式(5)还原过程中,加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为
②一定量
 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
您最近一年使用:0次
5 . 以含钛高炉渣(含 及少量
及少量 )和硫酸铵为原料制备钛白粉(主要成分
)和硫酸铵为原料制备钛白粉(主要成分 ),其流程可表示为:
),其流程可表示为:

已知: 只存在于强酸性溶液中,酸性减弱时易转化为
只存在于强酸性溶液中,酸性减弱时易转化为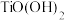 沉淀.
沉淀.
(1) 基态核外电子排布式为
基态核外电子排布式为______________ .
(2)“熔融”时,硫酸铵将 转化为
转化为 ,同时有气体生成.该气体的化学式为
,同时有气体生成.该气体的化学式为______________ .
(3)“水解”得到的滤渣 ,用氧化物的形式表示为
,用氧化物的形式表示为______________ .
(4)“沉淀”时, 与氨水反应的离子方程式是
与氨水反应的离子方程式是______________ .
(5)测定所得钛白粉样品的纯度,步骤如下:
步骤1:称取 样品,经熔融、溶解、还原等操作,将
样品,经熔融、溶解、还原等操作,将 完全转化为
完全转化为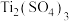 溶液.
溶液.
步骤2:将步骤1所得溶液冷却至室温,加入1~2滴 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定至终点,消耗该溶液
标准溶液滴定至终点,消耗该溶液 ,发生的反应为
,发生的反应为 ;
;
①滴定终点时的现象是______________ .
②计算样品中 的质量分数
的质量分数______________ (写出计算过程)
 及少量
及少量 )和硫酸铵为原料制备钛白粉(主要成分
)和硫酸铵为原料制备钛白粉(主要成分 ),其流程可表示为:
),其流程可表示为:
已知:
 只存在于强酸性溶液中,酸性减弱时易转化为
只存在于强酸性溶液中,酸性减弱时易转化为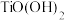 沉淀.
沉淀.(1)
 基态核外电子排布式为
基态核外电子排布式为(2)“熔融”时,硫酸铵将
 转化为
转化为 ,同时有气体生成.该气体的化学式为
,同时有气体生成.该气体的化学式为(3)“水解”得到的滤渣
 ,用氧化物的形式表示为
,用氧化物的形式表示为(4)“沉淀”时,
 与氨水反应的离子方程式是
与氨水反应的离子方程式是(5)测定所得钛白粉样品的纯度,步骤如下:
步骤1:称取
 样品,经熔融、溶解、还原等操作,将
样品,经熔融、溶解、还原等操作,将 完全转化为
完全转化为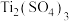 溶液.
溶液.步骤2:将步骤1所得溶液冷却至室温,加入1~2滴
 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定至终点,消耗该溶液
标准溶液滴定至终点,消耗该溶液 ,发生的反应为
,发生的反应为 ;
;①滴定终点时的现象是
②计算样品中
 的质量分数
的质量分数
您最近一年使用:0次
6 . 碱式氯化铜[Cu2(OH)2Cl2·3H2O]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中很稳定。
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分加持装置已省略)。
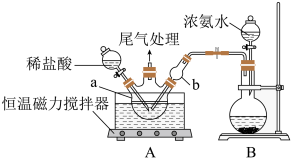
(1)碱式氯化铜中Cu(II)的核外电子排布式为___________ 。
(2)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是___________ (填名称)。
(3)反应过程中,需控制盐酸不能过量的原因是___________ 。
(4)反应结束后,将装置A中反应器内的混合物过滤,经提纯得产品无水碱式氯化铜,从滤液中还可以获得的副产品是___________ (填化学式)。
(5)碱式氯化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通空气制得,该反应的化学方程式为___________ 。
Ⅱ.采用沉淀滴定法测定碱式氯化铜中氯含量
(6)请补充完整测定氯的实验过程:取一定量碱式氯化铜固体,溶于稀硝酸,配制成一定体积待测液,准确量取25mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010 mol·L-1AgNO3溶液,直至静置后向上层清液中继续滴加0.010 mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1,___________ ,重复上述实验2~3次。
已知:①Ag+ + SCN— = AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。[须使用的实验试剂:0.010 mol·L-1NH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分加持装置已省略)。

(1)碱式氯化铜中Cu(II)的核外电子排布式为
(2)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是
(3)反应过程中,需控制盐酸不能过量的原因是
(4)反应结束后,将装置A中反应器内的混合物过滤,经提纯得产品无水碱式氯化铜,从滤液中还可以获得的副产品是
(5)碱式氯化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通空气制得,该反应的化学方程式为
Ⅱ.采用沉淀滴定法测定碱式氯化铜中氯含量
(6)请补充完整测定氯的实验过程:取一定量碱式氯化铜固体,溶于稀硝酸,配制成一定体积待测液,准确量取25mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010 mol·L-1AgNO3溶液,直至静置后向上层清液中继续滴加0.010 mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1,
已知:①Ag+ + SCN— = AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。[须使用的实验试剂:0.010 mol·L-1NH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
您最近一年使用:0次
名校
7 . 下表列出了九种元素在元素周期表中的位置。
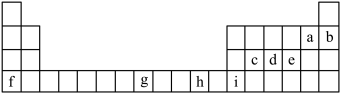
(1)这九种元素电负性最大的是_______ ,第一电离能最小的元素是_______ (均用元素符号填空)。
(2)这九种元素中最外层电子排布为4s1的元素为_______ (用元素符号填空)。
(3)c、d、e三种元素第一电离能由大到小的顺序是_______ ,电负性由大到小的顺序是_______ (均用元素符号填空)。
(4)写出g元素原子的价层电子轨道表达式_______ ,i元素原子基态电子排布式_______ 。

(1)这九种元素电负性最大的是
(2)这九种元素中最外层电子排布为4s1的元素为
(3)c、d、e三种元素第一电离能由大到小的顺序是
(4)写出g元素原子的价层电子轨道表达式
您最近一年使用:0次
名校
解题方法
8 . 磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的价电子排布式为_________ ;价电子中成对电子数______ 个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是________ 。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3____ H3PO4(填“>”或“<”),从结构的角度说明理由:_______ 。
(3)某磷青铜晶胞结构如图所示。
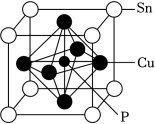
①则其化学式为________ 。
②该晶体中距离Cu原子最近的Sn原子有______ 个,这些Sn原子所呈现的构型为_______ 。
③若晶体密度为8.82g/cm3,最近的Cu原子核间距为_______ pm(用含NA的代数式表示)。
(1)基态铜原子的价电子排布式为
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3
(3)某磷青铜晶胞结构如图所示。

①则其化学式为
②该晶体中距离Cu原子最近的Sn原子有
③若晶体密度为8.82g/cm3,最近的Cu原子核间距为
您最近一年使用:0次
2024-01-07更新
|
59次组卷
|
2卷引用:四川省泸州市泸县第四中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
9 . 高锰酸钾具有强氧化性,广泛应用于化工、医药、金属冶炼等领域。实验室可通过固体碱溶氧化法制备高锰酸钾。回答下列问题:
(1)Mn元素在周期表中位于___________ 区,价电子排布式为___________ 。
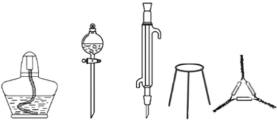
(2)将0.02mol 和0.09mol KOH置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,图中的实验仪器还需要
和0.09mol KOH置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,图中的实验仪器还需要___________ (填仪器名称)。
(3)将3.48g 分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色
分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色 。该步反应的化学方程式为
。该步反应的化学方程式为___________ ,分多次加入 的原因是
的原因是___________ 。
(4)待铁坩埚冷却后,将其置于蒸馏水中共煮至固体全部溶解。趁热向浸取液中通入 ,使
,使 (绿色)歧化为
(绿色)歧化为 与
与 。用玻璃棒蘸取溶液于滤纸上,观察到只有紫红色没有绿色痕迹时,表明转化已完全。静置片刻,抽滤。下表是部分化合物溶解度随温度变化的数据,
。用玻璃棒蘸取溶液于滤纸上,观察到只有紫红色没有绿色痕迹时,表明转化已完全。静置片刻,抽滤。下表是部分化合物溶解度随温度变化的数据, 不宜通入过多,原因是
不宜通入过多,原因是______________ 。
该步骤除了可以用 ,还可以选择哪种酸
,还可以选择哪种酸_____ 。
A.HCl B. C.
C.
(5)水浴加热滤液至出现 晶膜,冷却后抽滤、干燥晶体。利用水浴加热而不采取直接加热滤液的原因是
晶膜,冷却后抽滤、干燥晶体。利用水浴加热而不采取直接加热滤液的原因是___________ 。
(6)产品经纯化后称重,质量为3.60g。本实验中 的产率为
的产率为_____ %(保留三位有效数字)。
(1)Mn元素在周期表中位于
(2)将0.02mol
 和0.09mol KOH置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,图中的实验仪器还需要
和0.09mol KOH置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,图中的实验仪器还需要
(3)将3.48g
 分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色
分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色 。该步反应的化学方程式为
。该步反应的化学方程式为 的原因是
的原因是(4)待铁坩埚冷却后,将其置于蒸馏水中共煮至固体全部溶解。趁热向浸取液中通入
 ,使
,使 (绿色)歧化为
(绿色)歧化为 与
与 。用玻璃棒蘸取溶液于滤纸上,观察到只有紫红色没有绿色痕迹时,表明转化已完全。静置片刻,抽滤。下表是部分化合物溶解度随温度变化的数据,
。用玻璃棒蘸取溶液于滤纸上,观察到只有紫红色没有绿色痕迹时,表明转化已完全。静置片刻,抽滤。下表是部分化合物溶解度随温度变化的数据, 不宜通入过多,原因是
不宜通入过多,原因是| 温度/℃ | 20 | 30 | 40 | 50 |
 /g /g | 110 | 114 | 117 | 121 |
 /g /g | 33.7 | 39.9 | 47.5 | 65.6 |
 ,还可以选择哪种酸
,还可以选择哪种酸A.HCl B.
 C.
C.
(5)水浴加热滤液至出现
 晶膜,冷却后抽滤、干燥晶体。利用水浴加热而不采取直接加热滤液的原因是
晶膜,冷却后抽滤、干燥晶体。利用水浴加热而不采取直接加热滤液的原因是(6)产品经纯化后称重,质量为3.60g。本实验中
 的产率为
的产率为
您最近一年使用:0次
2024-01-05更新
|
226次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2023-2024学年高三上学期期末考试化学试卷
解题方法
10 . 钼精矿中含有 ,还含有
,还含有 的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。
的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。

已知:① 为一种有机萃取剂(用
为一种有机萃取剂(用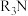 表示),卒取过程可表示:
表示),卒取过程可表示:
②高铼酸铵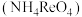 是白色片状晶体,微溶于冷水,溶于热水。
是白色片状晶体,微溶于冷水,溶于热水。
③铼是一种类锰元素,价电子与锰类似。
回答下列问题:
(1)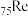 的价电子排布式为
的价电子排布式为___________ 。
(2)Re2O7所属的类型为___________ (填“酸性”“碱性”或“两性”)氧化物。
(3)钼精矿焙烧除了常见的氧化焙烧之外,还有石灰焙烧法, 、
、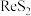 焙烧转化为
焙烧转化为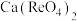 的化学方程式为
的化学方程式为___________ ,氧化焙烧法比较与石灰焙烧法的缺点是___________ 。
(4)试剂A适宜用___________ 。
(5)操作X为___________ 、过滤、洗涤、干燥。
(6)在 还原
还原 的过程中,实际
的过程中,实际 的用量大于理论值,原因是
的用量大于理论值,原因是___________ 。
 ,还含有
,还含有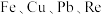 的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。
的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。
已知:①
 为一种有机萃取剂(用
为一种有机萃取剂(用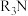 表示),卒取过程可表示:
表示),卒取过程可表示:
②高铼酸铵
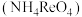 是白色片状晶体,微溶于冷水,溶于热水。
是白色片状晶体,微溶于冷水,溶于热水。③铼是一种类锰元素,价电子与锰类似。
回答下列问题:
(1)
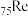 的价电子排布式为
的价电子排布式为(2)Re2O7所属的类型为
(3)钼精矿焙烧除了常见的氧化焙烧之外,还有石灰焙烧法,
 、
、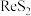 焙烧转化为
焙烧转化为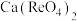 的化学方程式为
的化学方程式为(4)试剂A适宜用
(5)操作X为
(6)在
 还原
还原 的过程中,实际
的过程中,实际 的用量大于理论值,原因是
的用量大于理论值,原因是
您最近一年使用:0次



