1 . 回答下列问题:
(1)符号“3px”没有给出的信息是_______。
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
(4)下列比较正确的是_______。
(5)下列实验事实不能用氢键来解释的是_______。
(6)由磷原子核形成的三种微粒:a.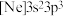 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为_______ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为_______ 。
(7)比较H-O-H键角大小;H3O+_______ H2O(填“>”、“<”或“=”)。
(8)胍(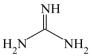 )分子中碳原子和氮原子共平面,胍中N杂化方式为
)分子中碳原子和氮原子共平面,胍中N杂化方式为_______ 。
(1)符号“3px”没有给出的信息是_______。
| A.能层 | B.能级 | C.电子云在空间的伸展方向 | D.电子的自旋方向 |
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是_______。
| A.4s1 | B.3p64s1 | C.3d54s1 | D.3d104s1 |
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是_______。
| A.HX | B.H2X | C.XH3 | D.XH4 |
(4)下列比较正确的是_______。
| A.酸性:H3PO4<H3AsO4 | B.熔点:MgO>CaO |
| C.离子半径:r(Al3+)>r(O2-) | D.键角:H2O>NH3 |
(5)下列实验事实不能用氢键来解释的是_______。
| A.CH4比SiH4稳定 |
| B.乙醇能与水以任意比互溶 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛 |
| D.接近沸点的水蒸气的相对分子质量测量值大于18 |
(6)由磷原子核形成的三种微粒:a.
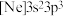 、b.
、b. 、c.
、c. ,半径由大到小的顺序为
,半径由大到小的顺序为(7)比较H-O-H键角大小;H3O+
(8)胍(
 )分子中碳原子和氮原子共平面,胍中N杂化方式为
)分子中碳原子和氮原子共平面,胍中N杂化方式为
您最近一年使用:0次
2 . 碳单质及其化合物广泛存在于人们的生产和生活中。研究碳单质及其化合物的结构、性质、转化是科技工作者的研究热点。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X: 的最外层电子排布式是
的最外层电子排布式是________________ 。
②X中除含共价键外,还含配位键, X含
X含________ mol配位键。
(2)温度为T时,在恒容密闭容器中充入一定量的 和
和 混合气体,发生反应:
混合气体,发生反应:

 。
。
已知该反应存在: ,
,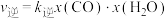 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的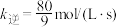 ,则
,则
________ 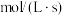 ,压强平衡常数
,压强平衡常数
________ 。
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(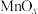 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。 、
、 反应的化学方程式是
反应的化学方程式是________________________ 。
②下列有关说法中,正确的有________ 。
A.相比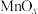 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率
B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气( 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:
反应ⅰ.
反应ⅱ.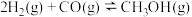
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(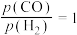 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含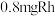 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为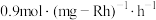 ,反应速率
,反应速率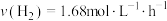 。
。
【注】(催化剂)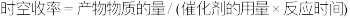 。
。
①反应速率
________  。
。
②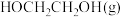 的时空收率为
的时空收率为________ 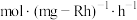 。
。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X:

 的最外层电子排布式是
的最外层电子排布式是②X中除含共价键外,还含配位键,
 X含
X含(2)温度为T时,在恒容密闭容器中充入一定量的
 和
和 混合气体,发生反应:
混合气体,发生反应:
 。
。已知该反应存在:
 ,
,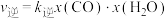 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的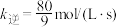 ,则
,则
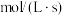 ,压强平衡常数
,压强平衡常数
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(
 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。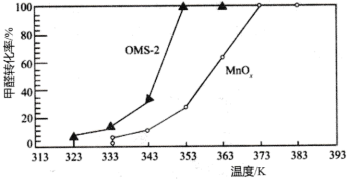
 、
、 反应的化学方程式是
反应的化学方程式是②下列有关说法中,正确的有
A.相比
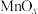 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气(
 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:反应ⅰ.

反应ⅱ.
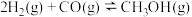
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(
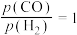 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含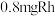 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为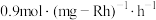 ,反应速率
,反应速率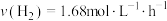 。
。【注】(催化剂)
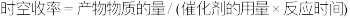 。
。①反应速率

 。
。②
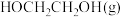 的时空收率为
的时空收率为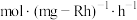 。
。
您最近一年使用:0次
名校
解题方法
3 . 一种利用电解锰阳极泥(锰主要以 和
和 的形式存在,主要杂质为
的形式存在,主要杂质为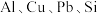 等)生产软磁用四氧化三锰的工艺流程如图:
等)生产软磁用四氧化三锰的工艺流程如图:
根据所学知识,回答下列问题:
(1)基态 的核外电子排布式为
的核外电子排布式为___________ 。
(2)焙烧的目的是将难溶矿物转化为易溶物,焙烧过程中 发生分解,生成盐A和气体
发生分解,生成盐A和气体 ,气体
,气体 分子的空间构型为平面三角形,请写出
分子的空间构型为平面三角形,请写出 分解的方程式
分解的方程式___________ 。
(3)酸浸的目的是___________ 。
(4)加氨水调节溶液 至7后过滤,滤液中c(Cu2+)≤
至7后过滤,滤液中c(Cu2+)≤_______ mol/L。
(5)“过滤”得到的滤渣主要成分为 、
、___________ 和___________ 。
(6)“沉锰”时发生的离子方程式为___________ 。
(7)“煅烧”需在空气中进行,试写出“煅烧”时发生的化学方程式为___________ 。
 和
和 的形式存在,主要杂质为
的形式存在,主要杂质为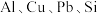 等)生产软磁用四氧化三锰的工艺流程如图:
等)生产软磁用四氧化三锰的工艺流程如图: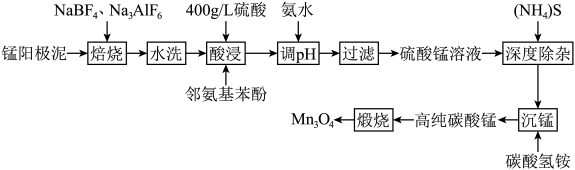
| 物质 |  |  |  |  |  |
 |  | 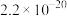 | 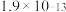 |  |  |
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)焙烧的目的是将难溶矿物转化为易溶物,焙烧过程中
 发生分解,生成盐A和气体
发生分解,生成盐A和气体 ,气体
,气体 分子的空间构型为平面三角形,请写出
分子的空间构型为平面三角形,请写出 分解的方程式
分解的方程式(3)酸浸的目的是
(4)加氨水调节溶液
 至7后过滤,滤液中c(Cu2+)≤
至7后过滤,滤液中c(Cu2+)≤(5)“过滤”得到的滤渣主要成分为
 、
、(6)“沉锰”时发生的离子方程式为
(7)“煅烧”需在空气中进行,试写出“煅烧”时发生的化学方程式为
您最近一年使用:0次
名校
4 . 下列说法正确的是
| A.元素C、N、O的第一电离能由大到小的顺序为O>N>C |
B. 中电负性最小的元素是N 中电负性最小的元素是N |
C.基态 的价电子排布式为 的价电子排布式为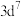 |
D. 的键角为120°, 的键角为120°, 的键角为120° 的键角为120° |
您最近一年使用:0次
名校
解题方法
5 . 过渡金属元素铬( )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)请写出基态铬( )原子价电子的轨道表示式
)原子价电子的轨道表示式___________ 。
(2)超分子的定义是广义的,包括离子。一种羟甲基酚钠盐形成的含铁超分子的化学式为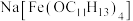 ,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:
,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:___________ 。
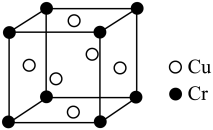
(3)某铜铬合金的立方晶胞结构如图所示。该铜铬合金的化学式为___________ ;离 原子最近的
原子最近的 原子数目为
原子数目为___________ ,离 原子最近的
原子最近的 原子数目为
原子数目为___________ 。若该晶胞参数为apm,则该晶体的密度为___________ 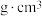 。
。___________ 种。其同主族元素Si可形成硅酸盐,下图中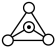 表示硅氧四面体,则该硅酸盐结构的通式为
表示硅氧四面体,则该硅酸盐结构的通式为___________ 。
 )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)请写出基态铬(
 )原子价电子的轨道表示式
)原子价电子的轨道表示式(2)超分子的定义是广义的,包括离子。一种羟甲基酚钠盐形成的含铁超分子的化学式为
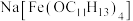 ,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:
,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:(3)某铜铬合金的立方晶胞结构如图所示。该铜铬合金的化学式为
 原子最近的
原子最近的 原子数目为
原子数目为 原子最近的
原子最近的 原子数目为
原子数目为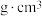 。
。
 表示硅氧四面体,则该硅酸盐结构的通式为
表示硅氧四面体,则该硅酸盐结构的通式为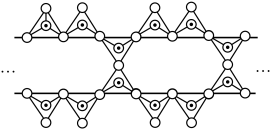
您最近一年使用:0次
6 . 科技的发展为新能源开发和新材料研制开拓出更大的空间。中科院科学家最近合成了一种新型材料,其结构简式为:___________ 种空间伸展方向;基态硒原子的价层电子排布式是___________ ;氟、氧、氮三种元素的第一电离能由大到小的顺序___________ (用元素符号表示)。
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它___________ (填“能”或“不能”)形成分子内或者分子间氢键,其原因是___________ 。
(3)硒能形成两种常见的氧化物,分子式为___________ 。
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是___________ 。
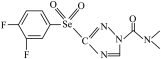
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它
(3)硒能形成两种常见的氧化物,分子式为
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是
您最近一年使用:0次
名校
7 . 有机反应中经常采用实验和量子学手段进行反应的微观探究。一种铜催化某有机反应历程如下,下列说法错误的是

| A.碘元素位于周期表p区 |
| B.催化剂可降低该反应的活化能,加快反应速率 |
| C.Tpy-[CuⅡ]CN-是中间产物 |
D.总反应方程式是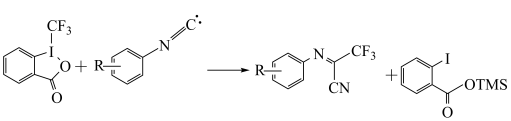 |
您最近一年使用:0次
名校
解题方法
8 . 以CO2为原料催化加氢可以制备CH4、CH3OH、C2H4, 为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
(1)基态 原子电子排布式为
原子电子排布式为___________ ,其核外不同能量状态的电子有___________ 种。
(2)CO 中的大
中的大 键可表示为
键可表示为___________ ,同一周期第一电离能大趋势在逐渐增大,但是存在反常,比如 ,请解释原因:
,请解释原因:___________ 。
(3) 催化加氢制备
催化加氢制备 的化学方程式为CO2+3H2=CH3OH+H2O。
的化学方程式为CO2+3H2=CH3OH+H2O。
①等物质的量的CH3OH和CO2分子中 键数目之比为
键数目之比为___________ 。
②沸点:CH3OH___________ (填“>”或“<”)CH4,其原因为___________ 。
(4)四方体 晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,
晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置, 、
、 、
、 原子的坐标参数分别为(0,0,0)、(
原子的坐标参数分别为(0,0,0)、( ,0,
,0, )、(
)、( ,
, ,
, )。
)。___________ ,配位数为___________ 。
②假设ZrO2的密度为 ,摩尔质量为
,摩尔质量为 ,
, 表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为
表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为___________  (列出算式即可)。
(列出算式即可)。
③将该晶体沿体对角线的方向投影如下图所示,请将O2-涂黑___________ 。
 为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:(1)基态
 原子电子排布式为
原子电子排布式为(2)CO
 中的大
中的大 键可表示为
键可表示为 ,请解释原因:
,请解释原因:(3)
 催化加氢制备
催化加氢制备 的化学方程式为CO2+3H2=CH3OH+H2O。
的化学方程式为CO2+3H2=CH3OH+H2O。①等物质的量的CH3OH和CO2分子中
 键数目之比为
键数目之比为②沸点:CH3OH
(4)四方体
 晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,
晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置, 、
、 、
、 原子的坐标参数分别为(0,0,0)、(
原子的坐标参数分别为(0,0,0)、( ,0,
,0, )、(
)、( ,
, ,
, )。
)。
②假设ZrO2的密度为
 ,摩尔质量为
,摩尔质量为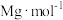 ,
, 表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为
表示阿伏加德罗常数的值,则晶胞中Zr和O原子的最短距离为 (列出算式即可)。
(列出算式即可)。③将该晶体沿体对角线的方向投影如下图所示,请将O2-涂黑

您最近一年使用:0次
名校
解题方法
9 . 离子液体被认为是21世纪最有希望的绿色溶液和功能材料之一,在诸多领域的用途已被研究开发。有几种离子液体由原子序数依次增大的短周期主族元素X、Y、Z、W、R、Q组成。请回答:
(1)基态Z原子的价电子排布式为________ ,基态Y原子占据最高能级的电子云轮廓图为________ 形。
(2)下列说法正确的是____。
(3)试解释 分子中X-W-X键角比
分子中X-W-X键角比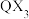 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因________ 。
(4)化合物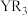 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。
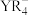 中Y原子的杂化方式为
中Y原子的杂化方式为________ , 晶体中含有
晶体中含有________  氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因________ 。 ,该晶体密度表达式为
,该晶体密度表达式为________  (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
| 元素 | 元素性质或原子结构 |
| X | 电子只有一种自旋取向 |
| Y | 2p能级上有1个电子 |
| Z | 有6个不同运动状态的电子 |
| W | 2p轨道处于半充满状态,简单氢化物易液化,可用作制冷剂 |
| R | 仅有一个未成对电子,简单阴离子含10个电子 |
| Q | 与W位于同一主族 |
(1)基态Z原子的价电子排布式为
(2)下列说法正确的是____。
| A.氢化物的沸点:R>Z | B.分子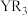 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.元素的电负性:R>X>Z | D.最高价含氧酸的酸性:W>Q |
(3)试解释
 分子中X-W-X键角比
分子中X-W-X键角比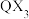 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因(4)化合物
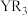 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。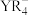 中Y原子的杂化方式为
中Y原子的杂化方式为 晶体中含有
晶体中含有 氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因 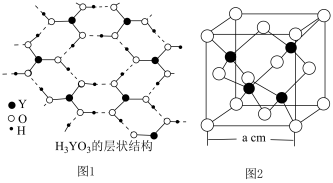
 ,该晶体密度表达式为
,该晶体密度表达式为 (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
您最近一年使用:0次
名校
解题方法
10 . 氟是卤族元素中原子半径最小的元素,氟的化合物种类繁多,用途广泛。回答下列问题:
(1)基态氟原子价电子的电子排布图为___________ ,其电子占据的最高能级的电子云轮廓图为___________ 。
(2) 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为___________ , 熔沸点比
熔沸点比 高的原因是
高的原因是___________ 。
(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:___________ 。晶体中不存在的化学键有___________ (填序号)
a.离子键 b. 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键
(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为___________ (图中交叉点均为碳原子)。 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  。
。
(1)基态氟原子价电子的电子排布图为
(2)
 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:| 熔点 | 沸点 | |
 | 993℃ | 1695℃ |
 | 1261℃ | 2260℃(分解) |
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为 熔沸点比
熔沸点比 高的原因是
高的原因是(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:

a.离子键 b.
 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为

 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 。
。
您最近一年使用:0次



