名校
解题方法
1 . X、Y、Z、W是短周期原子序数依次增大的四种常见主族元素,其原子结构及元素的性质见下表:
下列表达不正确的是
| X | Y | Z | W |
| 其单质有多种同素异形体,一种是自然界中最硬的物质 | 该元素的最高价氧化物的水化物与其气态氢化物生成离子化合物 | 原子序数比Y大2 | 主族序数是周期序数的2倍 |
| A.价电子数:Z>W>Y>X | B.最高价氧化物的水化物的酸性:W<X |
| C.X、Y、Z的第一电离能逐渐增大 | D.X、Y、Z的电负性逐渐增大 |
您最近一年使用:0次
2021-03-17更新
|
236次组卷
|
3卷引用:河北省武安市第三中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
2 . 短周期x、y、z、m、n五种主族元素,原子序数依次增大,x元素的某种原子可以在考古时用来测定文物年代。常温时,测得0.1mol/L y、m、n简单氢化物的水溶液pH分别为11、4、1。且z、m还可以与Na形成如图所以结构的化合物。以下有关说法错误的是
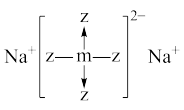
| A.原子半径:z<m<n |
| B.简单氢化物的沸点:x<y<z |
| C.电负性:z>y>x |
| D.x的最高价氧化物中各原子均满足8e-稳定结构 |
您最近一年使用:0次
2022-03-06更新
|
231次组卷
|
2卷引用:河北省邯郸市2021~2022学年高二上学期期末考试化学试题
11-12高二下·河北衡水·期末
名校
3 . 以下有关元素性质的说法不正确的是
| A.具有下列电子排布式①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4的原子中,原子半径最大的是① |
| B.具有下列价电子排布式①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4的原子中,第一电离能最大的是③ |
| C.①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而增大的是③ |
| D.某主族元素基态原子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703…,当它与氯气反应时生成的阳离子是X3+ |
您最近一年使用:0次
2018-12-03更新
|
589次组卷
|
11卷引用:河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题
河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)2011-2012学年河北省衡水中学高二下学期期末考试化学试卷2014-2015湖北省襄阳市五中高二3月月考化学试卷吉林省松原市扶余县第一中学2016-2017学年高二下学期期中考试化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质(已下线)2018年11月26日 《每日一题》一轮复习-元素性质的递变规律河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题辽宁省六校2021届高三上学期期中联考化学试题(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)
名校
4 . 下列晶体中,金属阳离子与“自由电子”间的作用最强的是
A.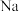 | B.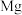 | C.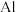 | D. |
您最近一年使用:0次
2019-01-12更新
|
467次组卷
|
8卷引用:河北省曲周县第一中学2018-2019学年高二上学期12月月考化学试题
河北省曲周县第一中学2018-2019学年高二上学期12月月考化学试题(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 第1课时 金属键与金属晶体鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型 第1课时 金属晶体(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 课时1 金属键与金属晶体(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第3节 离子键、配位键与金属键专题3 微粒间作用力与物质性质 第一单元 金属键 金属晶体 第1课时 金属键与金属特性浙江省宁波市北仑中学2022-2023学年高二下学期期中考试化学试题3.1.1金属键与金属特性 课后
5 . 短周期元素X、Y、Z、W的原子序数依次增大,X、W位于同主族但不相邻,基态Z原子价层电子排布式为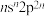 ,
, 是生活中常见的食品发泡剂。下列叙述正确的是
是生活中常见的食品发泡剂。下列叙述正确的是
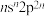 ,
, 是生活中常见的食品发泡剂。下列叙述正确的是
是生活中常见的食品发泡剂。下列叙述正确的是A.电负性: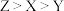 | B.第一电离能: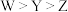 |
C.最简单氢化物的键角: | D.熔点: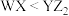 |
您最近一年使用:0次
2024-05-13更新
|
145次组卷
|
2卷引用:2024届河北省邯郸市高三下学期第四次调研检测化学试卷
名校
解题方法
6 . T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是______________ (用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是_____________ 。
(3)W的基态原子的外围电子排布式为_____________ ,W形成的晶体的堆积方式为___________ 。
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取__________ 杂化,1molM分子中σ键和π键的个数比为_____________ 。
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是_________________ 。
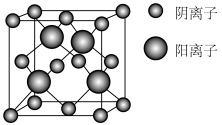
(6)WR的晶胞结构如图所示,阴离子周围最近的阳离子有____ 个;WR晶体的密度为ag·cm-3,则晶胞的体积是______ (只要求列出计算式)。
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是
(3)W的基态原子的外围电子排布式为
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是
(6)WR的晶胞结构如图所示,阴离子周围最近的阳离子有

您最近一年使用:0次
7 . ⅤA族元素及其化合物在生产、生活中用途广泛。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是____ 。
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]____ ,有____ 个未成对电子。
③P、S、As电负性由大到小的顺序是____ 。
(2)NH3、PH3、AsH3中沸点最高的是___ ,其主要原因是____ 。
(3)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为___ 。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:
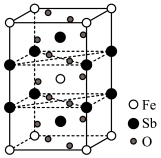
①锑酸亚铁的化学式为____ 。
②晶体的密度为___ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
③P、S、As电负性由大到小的顺序是
(2)NH3、PH3、AsH3中沸点最高的是
(3)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:

①锑酸亚铁的化学式为
②晶体的密度为
您最近一年使用:0次
解题方法
8 . 氟代硼铍酸钾晶体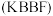 是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:
是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:
(1)基态K原子核外电子排布式为___________ ,在该原子中,原子轨道能量: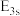
___________ (填“>”或“<”,下同)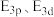
___________ 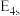 。
。
(2)上述四种元素中,第一电离能最小的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)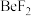 的空间构型为
的空间构型为___________ , 的杂化类型为
的杂化类型为___________ , 的键角比
的键角比 的键角
的键角___________ (填“大”或“小”),用价层电子对互斥理论解释原因为___________ 。
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:
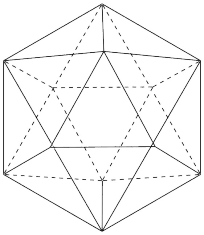
①晶体硼属于___________ 晶体,其理由是___________ 。
②每一个硼基本单元由___________ 个原子组成。
(5)已知 晶体具有
晶体具有 型结构,在
型结构,在 测出
测出 晶体密度为
晶体密度为 。
。 晶胞边长为
晶胞边长为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
 是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:
是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:(1)基态K原子核外电子排布式为
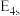 。
。(2)上述四种元素中,第一电离能最小的是
(3)
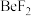 的空间构型为
的空间构型为 的杂化类型为
的杂化类型为 的键角比
的键角比 的键角
的键角(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于
②每一个硼基本单元由
(5)已知
 晶体具有
晶体具有 型结构,在
型结构,在 测出
测出 晶体密度为
晶体密度为 。
。 晶胞边长为
晶胞边长为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
您最近一年使用:0次
解题方法
9 . 已知 的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时,
的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时, 发生自偶电离,在稀溶液中的主要反应为
发生自偶电离,在稀溶液中的主要反应为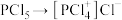 ,浓度较高时的主要反应为
,浓度较高时的主要反应为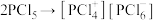 。下列说法正确的是
。下列说法正确的是
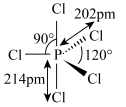
 的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时,
的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时, 发生自偶电离,在稀溶液中的主要反应为
发生自偶电离,在稀溶液中的主要反应为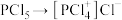 ,浓度较高时的主要反应为
,浓度较高时的主要反应为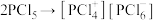 。下列说法正确的是
。下列说法正确的是
A. 中P满足8电子稳定结构 中P满足8电子稳定结构 | B.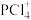 的空间构型为四面体形 的空间构型为四面体形 |
| C.P与Cl之间共用电子对偏向P | D. 属于非极性分子 属于非极性分子 |
您最近一年使用:0次
2023-06-12更新
|
66次组卷
|
2卷引用:河北省邯郸市永年区第二中学2022-2023学年高二下学期6月月考化学试题
解题方法
10 . 下列各项比较中,正确的是
A.酸性: | B.电负性: |
C.沸点: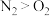 | D.中心原子孤电子对数: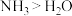 |
您最近一年使用:0次
2023-06-12更新
|
46次组卷
|
2卷引用:河北省邯郸市永年区第二中学2022-2023学年高二下学期6月月考化学试题



