解题方法
1 . 碳、氮和铬的相关化合物在药物化学及催化化学等领域应用广泛。请回答下列问题:
(1)基态铬原子价电子排布式为___ ,未成对电子数为___ 。
(2)铬的一种含氧酸——铬酸(H2CrO4),结构和硫酸类似。其阴离子CrO 的立体构型为
的立体构型为___ ,铬酸是一种二元强酸,原因是___ 。
(3)含铬的化合物吡啶甲酸铬是一种用于二型糖尿病的保健药,其结构如图所示。
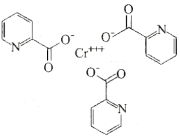
①该化合物中H、C、N、O的电负性由大到小的顺序为___ ,N原子的杂化轨道类型为___ 。
②该化合物中含有的化学键类型有___ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)铬的某种氧化物晶胞如图所示(灰球代表铬原子,黑球代表氧原子)。
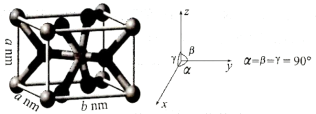
该氧化物的化学式为___ ,铬原子的配位数是___ ;该晶体的密度为___ g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即)。
(1)基态铬原子价电子排布式为
(2)铬的一种含氧酸——铬酸(H2CrO4),结构和硫酸类似。其阴离子CrO
 的立体构型为
的立体构型为(3)含铬的化合物吡啶甲酸铬是一种用于二型糖尿病的保健药,其结构如图所示。

①该化合物中H、C、N、O的电负性由大到小的顺序为
②该化合物中含有的化学键类型有
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)铬的某种氧化物晶胞如图所示(灰球代表铬原子,黑球代表氧原子)。

该氧化物的化学式为
您最近一年使用:0次
解题方法
2 . X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y原子的电子总数是内层电子数的4倍,Y和R同主族,Y和Z最外层电子数之和与W的最外层电子数相同。25℃时,0.1mol/L X和W形成化合物的水溶液pH=1.下列说法正确的是
| A.电负性:Y>W>R>Z |
| B.Y、Z、W三种元素组成的化合物的水溶液一定显碱性 |
| C.简单离子的半径:R>W>Y>Z |
| D.因X与Y组成的分子间存在氢键,所以X与Y组成的分子比X与R组成的分子稳定 |
您最近一年使用:0次
解题方法
3 . 科学家发现铂金按一定比例混合可以获得迄今为止最强的合金。该合金的耐磨性比高强度钢高100倍,可用于制造新型发电系统,发动机和其他设备。已知金为第六周期元素,与铜均属ⅠB族。回答下列问题:
(1)基态Au原子中,核外电子占据的最低能层符号是_________ ,其价电子层的电子排布式为___________ ,简要说明Au熔点低于Cu熔点的原因__________ 。
(2)金、氯两种元素的电负性如下表。AuCl属于_________ (填“共价”或“离子”)化合物。
(3)Au易溶于王水的原因是形成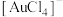 。
。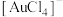 的配位数是
的配位数是____ ,该离子的结构式为____ 。
(4)用 作催化剂可完成甲醇脱氢,最优路径为
作催化剂可完成甲醇脱氢,最优路径为 。等物质的量的甲醇与一氧化碳中
。等物质的量的甲醇与一氧化碳中 键的数目比为
键的数目比为_____________ 。
(5)利用X—射线衍射法发现金(Au)晶体的晶胞如图所示。该晶体的密度为 ,晶胞的边长为apm,则阿伏加 德罗常数为
,晶胞的边长为apm,则阿伏加 德罗常数为_______________ (用含 的代数式表示)
的代数式表示) 。
。

(1)基态Au原子中,核外电子占据的最低能层符号是
(2)金、氯两种元素的电负性如下表。AuCl属于
| 元素 | Au | Cl |
| 电负性 | 2.54 | 3.2 |
(3)Au易溶于王水的原因是形成
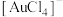 。
。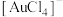 的配位数是
的配位数是(4)用
 作催化剂可完成甲醇脱氢,最优路径为
作催化剂可完成甲醇脱氢,最优路径为 。等物质的量的甲醇与一氧化碳中
。等物质的量的甲醇与一氧化碳中 键的数目比为
键的数目比为(5)利用X—射线衍射法发现金(Au)晶体的晶胞如图所示。该晶体的密度为
 ,晶胞的边长为apm,则阿伏加 德罗常数为
,晶胞的边长为apm,则阿伏加 德罗常数为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解题方法
4 .  是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:
(1) 为ⅣA族元素,与同主族
为ⅣA族元素,与同主族 元素比较,电负性
元素比较,电负性
___ (填“>”或“<”) 。单质
。单质 与干燥
与干燥 反应生成
反应生成 。
。 空间构型为
空间构型为___ 。
(2)基态 原子的核外电子排布式为
原子的核外电子排布式为__ 。 的氢化物的沸点比
的氢化物的沸点比 的
的__ (填“高”或“低”),判断理由是___ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有
配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有__ mol,该螯合物中N的杂化方式有___ 种。

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系 的晶胞结构如下图所示,晶胞梭边夹角均为
的晶胞结构如下图所示,晶胞梭边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
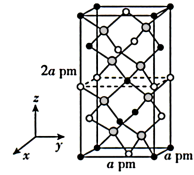
一个晶胞中有__ 个 ,找出距离Cd(0,0,0)最近的
,找出距离Cd(0,0,0)最近的
__ (用分数坐标表示)。 晶体中与单个
晶体中与单个 键合的
键合的 有
有__ 个。
 是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:(1)
 为ⅣA族元素,与同主族
为ⅣA族元素,与同主族 元素比较,电负性
元素比较,电负性
 。单质
。单质 与干燥
与干燥 反应生成
反应生成 。
。 空间构型为
空间构型为(2)基态
 原子的核外电子排布式为
原子的核外电子排布式为 的氢化物的沸点比
的氢化物的沸点比 的
的(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有
配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系
 的晶胞结构如下图所示,晶胞梭边夹角均为
的晶胞结构如下图所示,晶胞梭边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
| 坐标 原子 | x | y | z |
 | 0 | 0 | 0 |
 | 0 | 0 | 0.5 |
 | 0.25 | 0.25 | 0.125 |
一个晶胞中有
 ,找出距离Cd(0,0,0)最近的
,找出距离Cd(0,0,0)最近的
 晶体中与单个
晶体中与单个 键合的
键合的 有
有
您最近一年使用:0次
名校
解题方法
5 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______ ,尿素分子间的氢键可表示为______ 。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______ 。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______  填序号
填序号 。
。
A.离子键 B.金属键 C.配位键 D.σ键 E.π键
③ 中N原子杂化后的价电子排布图为
中N原子杂化后的价电子排布图为______ , 的空间构型为
的空间构型为______ 。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
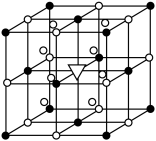
①Mg2NiH4中H的化合价为______ 。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______ nm(用含d、M的代数式表示)。
(1)尿素中所含元素的电负性最大的是
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是
②[Fe(H2NCONH2)6](NO3)3中存在的化学键
 填序号
填序号 。
。A.离子键 B.金属键 C.配位键 D.σ键 E.π键
③
 中N原子杂化后的价电子排布图为
中N原子杂化后的价电子排布图为 的空间构型为
的空间构型为Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。

①Mg2NiH4中H的化合价为
②Mg2+位于Ni原子形成的
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为
您最近一年使用:0次
7 . 下列有关元素及其化合物性质的说法中正确的是
A. 与 与 发生水解反应,水解产物中都有HI 发生水解反应,水解产物中都有HI |
| B.ⅣA族元素单质的晶体类型相同 |
C.N的电负性比P大,可推断 分子的极性比 分子的极性比 分子的极性大 分子的极性大 |
D. 的熔沸点高于HF,可推断 的熔沸点高于HF,可推断 分子间氢键比HF分子间氢键多 分子间氢键比HF分子间氢键多 |
您最近一年使用:0次
8 . 下列说法错误的是
| A.在1个CsCl晶胞中含有1个Cs+ |
| B.SO2在水中的溶解度比CO2在水中的溶解度要大 |
| C.X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X |
| D.根据电子排布的特点,Cu和Ga在周期表中都属于d区 |
您最近一年使用:0次
解题方法
9 . [化学—选修物质结构与性质]
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。
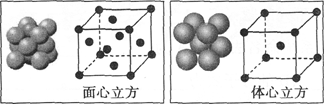
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。

您最近一年使用:0次
10 . 以下有关元素性质的说法不正确的是
| A.具有下列电子排布式的原子:①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是④ |
| B.具有下列价电子排布式的原子:①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb ②N、P、S ③Na、P、Cl,元素的电负性随原子序数增大而增大的是③ |
| D.某主族元素气态基态离子的逐级电离能数据(单位:kJ·mol-1)分别为738、1451、7733、10540、13630、17995、21703……它与氯气反应时,生成的阳离子是X3+ |
您最近一年使用:0次



