名校
解题方法
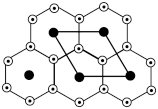
1 . 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
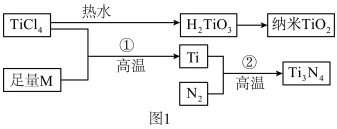
图中的M是短周期金属元素,M的部分电离能如表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________ 。
(2)M是________ (填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____ 。
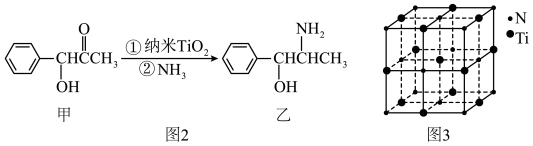
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________ 个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________ 。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________ g/cm3 (NA为阿伏加 德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________ 个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________ 。

图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为
(2)M是
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
您最近一年使用:0次
2020-03-30更新
|
297次组卷
|
7卷引用:2016届福建省漳州八校高三下学期第三次联考理科综合化学试卷
2 . 回答下列问题:
(1)下列现象与原子核外电子跃迁有关的是___________ (填序号)。
a.焰火 b.LED灯光 c.金属导电
(2)在周期表中,与Li的化学性质最相似的邻族元素是___________ 。
(3)硼、钛等元素的化合物具有广泛的应用价值。
①B原子中存在未成对电子的能级电子云在空间有___________ 种伸展方向。
② (硼氢化钛)可由
(硼氢化钛)可由 和
和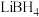 反应制得。基态钛原子的价层电子轨道表示式为
反应制得。基态钛原子的价层电子轨道表示式为___________ 。电负性大小顺序为H___________ B(填“>”或“<”)。
(4)氮单质及其化合物在研究和生产中有着广泛的应用。
①亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到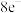 结构,则其电子式为
结构,则其电子式为___________ ,其水解会生成两种酸,写出水解的化学方程式___________ 。
②氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为___________ ;
(1)下列现象与原子核外电子跃迁有关的是
a.焰火 b.LED灯光 c.金属导电
(2)在周期表中,与Li的化学性质最相似的邻族元素是
(3)硼、钛等元素的化合物具有广泛的应用价值。
①B原子中存在未成对电子的能级电子云在空间有
②
 (硼氢化钛)可由
(硼氢化钛)可由 和
和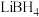 反应制得。基态钛原子的价层电子轨道表示式为
反应制得。基态钛原子的价层电子轨道表示式为(4)氮单质及其化合物在研究和生产中有着广泛的应用。
①亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到
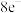 结构,则其电子式为
结构,则其电子式为②氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为

您最近一年使用:0次
名校
解题方法
3 . 铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___ ;C、N、O的电负性由大到小的顺序为______ 。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______ ;配合物[Cu(NH3)2]OOCCH3中,铜显___ 价,碳原子的杂化轨道类型是______ ,NH3价电子对互斥理论模型是______ 。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________ (填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________ 。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________ ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________ (写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

(1)基态Fe原子的核外电子排布式为[Ar]
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为

您最近一年使用:0次
2019-05-07更新
|
428次组卷
|
2卷引用:【校级联考】福建省莆田第一中学、第四中学2019届高三下学期一模理科综合化学试题
名校
解题方法
4 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为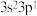 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
5 . 下列各项叙述中,正确的是
| A.d区中,族序数最大、原子序数最小的元素,它+3价离子比+2价离子稳定 |
| B.最外层电子数为ns2的原子,其价电子数也为2 |
| C.第一电离能越大,元素的电负性也越大 |
| D.“电子云”中的小黑点是电子在核外某空间内出现过的痕迹 |
您最近一年使用:0次
2022-04-25更新
|
129次组卷
|
2卷引用:福建省福州市八县(市)一中2021-2022学年高二下学期期中联考化学试题
解题方法
6 . 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。
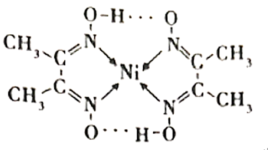
①基态Ni原子的电子排布式为___________ ,该元素在元素周期表中的位置是___________ 。
②元素C、N、O的电负性由大到小顺序为___________ 。
③二丁二酮肟合镍中存在的化学键有___________ (填标号)。
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为___________ 。
(2)工业上采用反应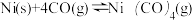 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有___________ 个δ键。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。
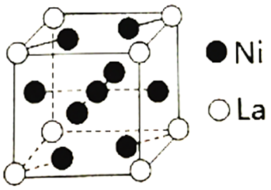
①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为___________ g·cm-3。
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为___________ 。
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。

①基态Ni原子的电子排布式为
②元素C、N、O的电负性由大到小顺序为
③二丁二酮肟合镍中存在的化学键有
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为
(2)工业上采用反应
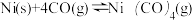 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。

①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
②Co2+的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是___________ 。
(4)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为___________ 。
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为___________ (用含a和ρ的最简代数式表示)
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为
您最近一年使用:0次
名校
解题方法
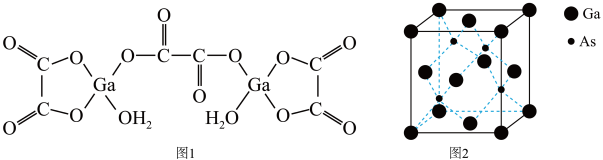
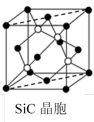
8 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________ ,As基态原子核外有__________ 个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________ ,Ga、As、Se的电负性由大到小的顺序是__________________ 。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________ ,GaF的熔点超过1000℃,可能的原因是__________________________ 。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________ ,草酸根离子中碳原子的杂化轨道类型为__________ 。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________ g·cm-3(设NA为阿伏加 德罗常数的值,列出计算式即可)。
(1)Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
| 镓的卤化物 | CaCl3 | CaBr3 | CaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为

您最近一年使用:0次
2020-02-11更新
|
240次组卷
|
6卷引用:福建省莆田市第九中学2019届高三上学期第一次调研考试理科综合化学试题
解题方法
9 . 第三代半导体中,碳化硅(SiC)和氮化镓(GaN)是核心半导体。它们具有更宽的禁带宽度、更高的导热率、更高的抗辐射能力、更大的电子饱和漂移速率等特性。
(1)基态Ga原子的价电子排布式为_______ 。
(2)晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为_______ 。
(3)氮化镓不存在于自然界中,只能通过人工合成来制备,反应为 。
。
①GaCl3熔点为77.9℃,其晶体类型为_______ 。GaF3的熔点为1000℃,则将GaF3熔化时,被破坏的作用力是_______ 。
②上述反应涉及的元素中,电负性最小的是_______ (填元素符号,下同),第一电离能最大的是_______ 。
(1)基态Ga原子的价电子排布式为
(2)晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为
(3)氮化镓不存在于自然界中,只能通过人工合成来制备,反应为
 。
。①GaCl3熔点为77.9℃,其晶体类型为
②上述反应涉及的元素中,电负性最小的是
您最近一年使用:0次
解题方法
10 . Al、Fe、Cu是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___ 。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于___ 晶体。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是原子___ (填名称)。
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因___ 。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是___ ;SiO2中Si原子采取___ 杂化。
(5)金刚砂(SiC)晶胞如图所示:
沿晶胞图中虚线方向的切面图为___ (填标号)。
a.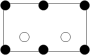 b.
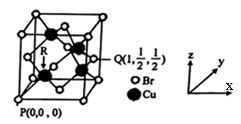
b.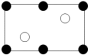
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是___ ,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为___ ;已知晶胞参数为a pm,其密度为___ g/cm3。(列出计算式即可)
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是
(5)金刚砂(SiC)晶胞如图所示:

沿晶胞图中虚线方向的切面图为
a.
 b.
b.
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是

您最近一年使用:0次



