名校
解题方法
1 . 我国某科研团队制得一种超分子功能材料,反应如下:
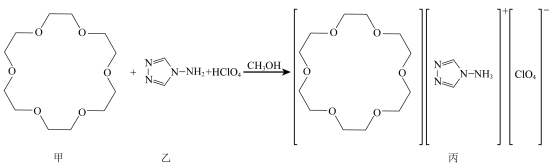
A. 分子中3个非羟基氧吸电子,使 分子中3个非羟基氧吸电子,使 键极性增大,易电离出 键极性增大,易电离出 |
| B.乙质子化后形成的阳离子嵌入甲的环内,通过氢键结合形成超分子 |
| C.丙含有的H、C、N、O和Cl五种元素中,O的电负性和第一电离能均最大 |
| D.若将乙更换为其类似物,则可根据其阳离子大小选择空腔适合的甲的类似物 |
您最近一年使用:0次
2 . 单团簇催化剂(SCCs)是指由多个金属原子组成的亚纳米小颗粒,对其结构、性能、应用的研究具有广阔的前景。
(1)某SCCs的结构如下:
反应i.2NO(g)+2H2(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;
反应ii.2NO(g)+5H2(g) 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。
则NH3(g)
 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=________ kJ·mol-1。
(3)在 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如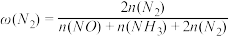 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。________ 、____ 。(填“ ”“
”“ ”或“
”或“ ”)
”)
②若选择对反应ii催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应i的平衡常数 =
=____ kPa-1(列出计算式即可,平衡时分压代替平衡浓度)。
(1)某SCCs的结构如下:
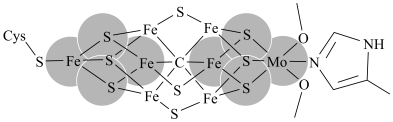
Cys的结构简式为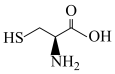 ,其组成元素中电负性从大到小依次是
,其组成元素中电负性从大到小依次是
反应i.2NO(g)+2H2(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;反应ii.2NO(g)+5H2(g)
 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。则NH3(g)

 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=(3)在
 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如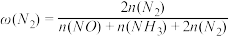 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。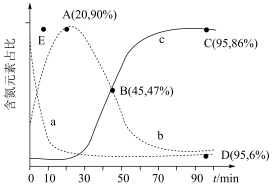
 ”“
”“ ”或“
”或“ ”)
”)②若选择对反应ii催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应i的平衡常数
 =
=
您最近一年使用:0次
3 . X、Y、Z、W、Q五种元素的原子序数依次增大。甲、乙、丙、丁、戊为这些元素形成的化合物,R、T为其中两种元素对应的单质,T为紫红色金属,甲的水溶液显弱碱性,丁为常见无色透明且有特殊香味的液体。它们之间的转化关系如图。下列说法错误的是
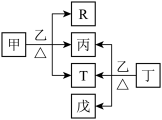
| A.第一电离能:Z>W>Y |
| B.电负性:W>Z>Y>X |
| C.X、Y、Z、W四种元素不能组成两性化合物 |
| D.X、Y、Z、Q分属于元素周期表3个不同的分区 |
您最近一年使用:0次
4 . X、Y、Z、Q、R是分别占据5个主族和前四周期的五种元素,原子序数依次增大。基态Y原子的5个轨道上都有电子、基态Z原子核外有3个未成对电子、Q的单质(常温下为气态)和NaOH溶液在常温下发生歧化反应生成两种盐,R的L和M层电子数相同。下列说法正确的是
| A.Y和R形成的化合物只含有离子键 | B.X和Q基态原子的未成对电子数不同 |
| C.元素电负性:Z>Q>R | D.Z和Q形成的分子可能是极性分子 |
您最近一年使用:0次
5 . 下列事实与解释不对应的是
| 事实 | 解释 | |
| A | 某些金属盐灼烧呈现不同的颜色 | 电子从低能轨道跃迁至高能轨道时吸收波长不同 |
| B | 金属的电导率随温度升高而降低 | 金属中的自由电子在热的作用下与金属原子频繁碰撞 |
| C | 酸性:CF3COOH>CH3COOH | -CF3为吸电子基团、-CH3为推电子基团 |
| D | 熔点:金刚石>晶体硅 | 金刚石中C-C键长比晶体硅中Si-Si键长短 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 氮、磷化合物在科研和生产中有许多重要用途。回答下列问题:
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为_________ ,H、B、N的电负性由大到小的顺序为____ 。与氨硼烷互为等电子体的分子是_______ (写名称),其熔点比NH3BH3低,原因是__________ 。
(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状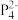 结构与苯相似,
结构与苯相似,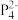 中的大π键可表示为
中的大π键可表示为___________ 。
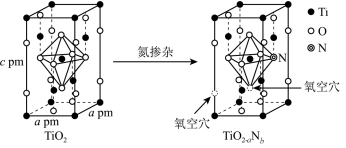
___ 种,TiO2晶胞的密度为_________ g/cm3,TiO2-aNb 晶体中a:b=_________ 。
(1)氨硼烷(NH3BH3)是极具潜力的固体储氢材料,分子中与N原子相连的H呈正电性(H
 +),与B原子相连的H呈负电性(H
+),与B原子相连的H呈负电性(H -)。B原子的杂化方式为
-)。B原子的杂化方式为(2)南开大学某课题组成功合成[FeP6]2-。结构如图,环状
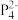 结构与苯相似,
结构与苯相似,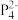 中的大π键可表示为
中的大π键可表示为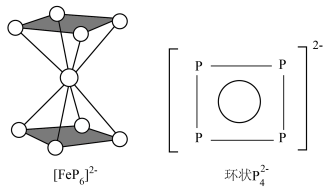
您最近一年使用:0次
7 . Q、W、X、Y、Z为原子序数依次增大的前30号元素。W、X、Y同周期且相邻,W的基态原子各能级的电子数相同;Q和Z的基态原子都只有一个未成对电子,基态Z原子的其他电子层电子均处于饱和状态。由它们组成的某种离子的结构如图所示,其中Z显 价。下列说法错误的是
价。下列说法错误的是
 价。下列说法错误的是
价。下列说法错误的是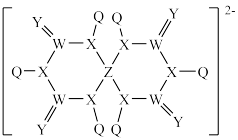
A.简单离子半径: |
B.电负性: |
| C.W、Y均可与Q形成至少两种化合物 |
D.最高价氧化物对应水化物的酸性: |
您最近一年使用:0次
名校
解题方法
8 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: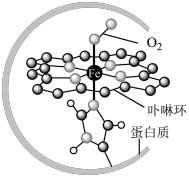
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
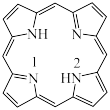
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。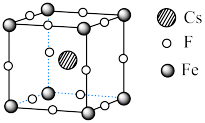
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
7日内更新
|
192次组卷
|
2卷引用:北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题
解题方法
9 . X、Y、Z、Q、W是原子序数依次增大的五种元素,其中X是宇宙中含量最多的元素;Y原子s能级上的电子数比p能级上的电子数多1,Z元素价层电子中有2个单电子;Q元素原子核外的电子有11种不同运动状态,W元素价层电子排布式可表示为 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是A.电负性: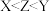 |
B. 是一种酸性氧化物 是一种酸性氧化物 |
| C.Y、Q、Z元素组成的化合物水溶液可能呈中性 |
| D.Z与W元素形成的化合物可用于制造二次电池的负极材料 |
您最近一年使用:0次
名校
10 . 如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是
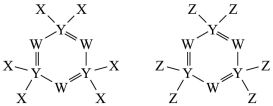
| A.电负性:X>Y>Z |
| B.HZO为弱酸,分子的空间结构为直线型 |
| C.最高价含氧酸酸性:W<Y |
| D.X、W和氢三种元素可形成含阴阳离子都为10电子的化合物 |
您最近一年使用:0次



