解题方法
1 . 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:
(1)基态铁原子的价电子排布图为_______ ,基态铁原子核外电子的空间运动状态有_______ 种, 其处在最高能层的电子的电子云形状为_______ 。
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。
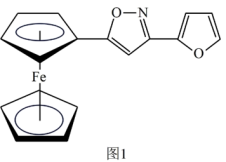
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为_______ (填序号)。
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为_______ 。
(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。
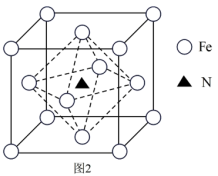
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_______ 。
②该化合物的化学式为_______
(1)基态铁原子的价电子排布图为
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②该化合物的化学式为
您最近一年使用:0次
2022高三·全国·专题练习
2 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(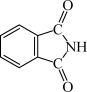 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
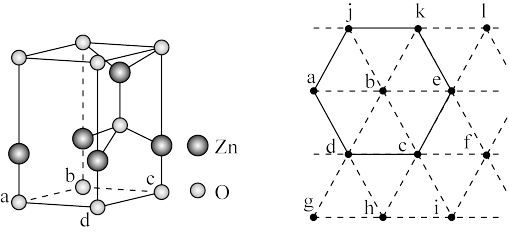
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9225次组卷
|
11卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)2022年海南省高考真题变式题15-19山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)
名校
解题方法
3 . 主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
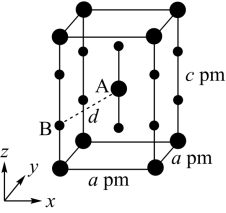
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2022-05-02更新
|
863次组卷
|
7卷引用:陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题
陕西省汉中市2022届高三教学质量第二次检测考试理科综合能力测试化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
4 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
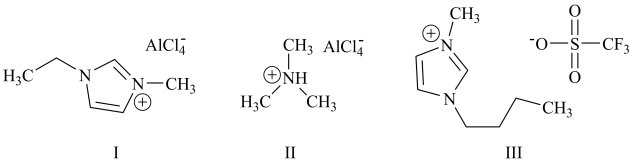
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.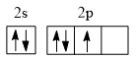 | B.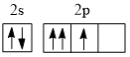 | C.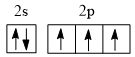 | D.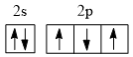 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
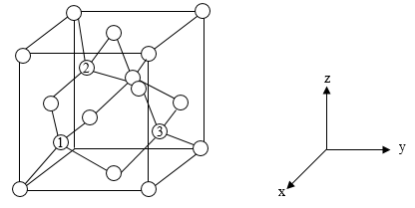
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2774次组卷
|
10卷引用:广东省广州市2022届高三一模考试化学试题
广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)江西省新余市2022届高三第二次模拟考试理综化学试题吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
5 . I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为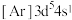
B.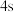 电子能量较高,总是在比
电子能量较高,总是在比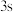 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为
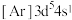
B.
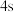 电子能量较高,总是在比
电子能量较高,总是在比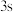 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
6 . 中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是___ ,基态Zn价电子排布式为___ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为___ 。
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是___ 。
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是___ 。
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为___ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___ 。
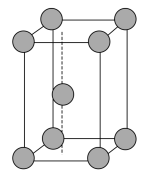
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是___ (用含π的代数式表示)。
(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是

您最近一年使用:0次
解题方法
7 . 环己酮是重要的化工原料和化工溶剂,某研究小组对其进行了一些探究。
Ⅰ.环己酮的制备。反应原理为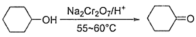 ,还原产物为
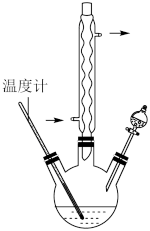
,还原产物为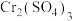 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
已知: 溶液呈橙红色,
溶液呈橙红色,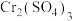 溶液呈墨绿色。
溶液呈墨绿色。
(1)分液漏斗中盛放的试剂为_______ 。(填字母)
a. 溶液 b.环己醇的硫酸溶液
溶液 b.环己醇的硫酸溶液
(2)三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为_______ 。
(3)反应结束后,还需滴加甲醇,直到_______ (填实验现象)为止,随后分离提纯得到环己酮。
(4)若20.0 mL环己醇(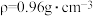 )完全反应并提纯后,得到纯环己酮(
)完全反应并提纯后,得到纯环己酮(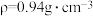 )9.6 mL,则环己酮的产率为
)9.6 mL,则环己酮的产率为_______ 。(计算结果保留2位有效数字)
Ⅱ.环己酮的结构与性质
(5)环己酮中三种元素的电负性由小到大的顺序为_______ 。(用元素符号表示)
(6)若要测定环己酮的相对分子质量,可以采用的波谱分析手段为_______ 。
(7)已知: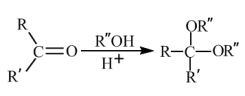 。环己酮和乙二醇在酸性条件下反应生成分子式为
。环己酮和乙二醇在酸性条件下反应生成分子式为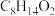 的产物,其结构简式为
的产物,其结构简式为_______ 。
Ⅰ.环己酮的制备。反应原理为
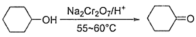 ,还原产物为
,还原产物为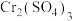 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
已知:
 溶液呈橙红色,
溶液呈橙红色,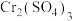 溶液呈墨绿色。
溶液呈墨绿色。(1)分液漏斗中盛放的试剂为
a.
 溶液 b.环己醇的硫酸溶液
溶液 b.环己醇的硫酸溶液(2)三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为
(3)反应结束后,还需滴加甲醇,直到
(4)若20.0 mL环己醇(
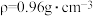 )完全反应并提纯后,得到纯环己酮(
)完全反应并提纯后,得到纯环己酮(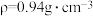 )9.6 mL,则环己酮的产率为
)9.6 mL,则环己酮的产率为Ⅱ.环己酮的结构与性质
(5)环己酮中三种元素的电负性由小到大的顺序为
(6)若要测定环己酮的相对分子质量,可以采用的波谱分析手段为
(7)已知:
 。环己酮和乙二醇在酸性条件下反应生成分子式为
。环己酮和乙二醇在酸性条件下反应生成分子式为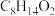 的产物,其结构简式为
的产物,其结构简式为
您最近一年使用:0次
2021-07-02更新
|
435次组卷
|
2卷引用:江苏省泰州市2020-2021学年高二下学期期末考试化学试题
名校
解题方法
8 . 人体血红蛋白中含有Fe2+一卟啉环配合物,结合O2后,其基本结构如图(烃基略去)。回答下列问题:
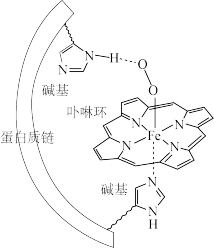
(1)Fe、N、C、H四种元素中电负性最大的是____ (填写元素符号);血红蛋白结合O2前后的中心Fe均为正二价,其基态时3d轨道中电子数为____ 。
(2)卟啉环中所有原子共平面,其中N的杂化方式为____ ,C-Nσ键有____ 个。
(3)图中Fe2+的配位数为__________ ;其中一个碱基通过 ____ 作用与O2分子结合,另一碱基的N原子提供____ 与Fe2+配位。
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更___ (填“高”或“低”),说明理由____ 。
(5)从298K升温到1200K时,体心立方型的δ -Fe变化为面心立方最密堆积,配位数____ (填“变大”、“不变”或“变小”)。假定升温时Fe原子半径不变,体积变为低温时的___ %(已知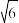 =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。

(1)Fe、N、C、H四种元素中电负性最大的是
(2)卟啉环中所有原子共平面,其中N的杂化方式为
(3)图中Fe2+的配位数为
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更
(5)从298K升温到1200K时,体心立方型的δ -Fe变化为面心立方最密堆积,配位数
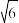 =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。
您最近一年使用:0次
2021-04-04更新
|
533次组卷
|
2卷引用:四川省成都市2021届高三第二次诊断性检测理综化学试题
解题方法
9 . 草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷等,其制备原理为:Fe(OH)3+3NH4HC2O4=(NH4)3[Fe(C2O4)3]+3H2O。
回答下列问题:
(1)基态C原子核外电子云有__ 种形状;基态铁原子最先失去__ 能级(填能级符号)上的电子。
(2)(NH4)3[Fe(C2O4)3]中C2O 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
①该配合物中所含非金属元素的电负性由大到小的顺序为__ (用元素符号表示)。
②上述配合物的中心离子配位数为___ 。
③1molC2O 中含有σ键的数目为
中含有σ键的数目为__ 在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为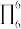 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为__ 。
(3)写出一种与NH 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式__ ;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为__ ;CH4、NH3、H2O分子中键角由大到小的顺序为__ 。
(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为__ g·cm-3。

回答下列问题:
(1)基态C原子核外电子云有
(2)(NH4)3[Fe(C2O4)3]中C2O
 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。①该配合物中所含非金属元素的电负性由大到小的顺序为
②上述配合物的中心离子配位数为
③1molC2O
 中含有σ键的数目为
中含有σ键的数目为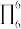 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为(3)写出一种与NH
 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为

您最近一年使用:0次
2021-01-31更新
|
549次组卷
|
2卷引用:贵州省盘州市2021届高三第一次模拟考试理科综合化学试题
解题方法
10 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)Co3+的价电子排布图为:___ ;基态磷原子有___ 种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:___ 。
(3)写出一种与PO 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:___ ,该分子的中心原子的价层电子对数等于___ 。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:___ 。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:___ 。
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:___ ,若晶胞参数为bnm,阿伏加德罗常数的值为NA,则Li2O的密度为___ g·cm-3(列出计算式即可),O2-和Li+的最短距离等于__ nm(用含b的代数式表示)。
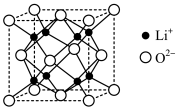
(1)Co3+的价电子排布图为:
(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)写出一种与PO
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:

您最近一年使用:0次



