名校
解题方法
1 . 一种元素原子的价电子构型为2s22p5,下列有关它的描述正确的有
| A.在周期表中电负性最大 | B.在周期表中第一电离能最大 |
| C.在周期表中原子半径最小 | D.核外电子只有7种运动状态 |
您最近一年使用:0次
名校
解题方法
2 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子轨道排布式是_______ 。
(2)C、N、O三种元素第一电离能从小到大的顺序是_______ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是_______ 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有_______ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在_______ (填标号)。
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_______ (填标号)。
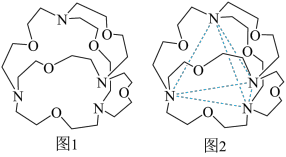
a.CF4 b.NH c.H2O d.CH4
c.H2O d.CH4
(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是_______ 。
(1)基态氮原子的电子轨道排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

a.CF4 b.NH
 c.H2O d.CH4
c.H2O d.CH4(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是
您最近一年使用:0次
2021-05-14更新
|
126次组卷
|
2卷引用:福建省三明市三地三校2020-2021学年高二下学期期中联考化学试题
3 . 科学工作者合成了含镁、镍、碳3种元素的超导材料,具有良好的应用前景,回答下列问题:
(1)镍元素位于周期表第_______ 列,基态镍原子d轨道中成对电子与单电子的数量比为_______ 。
(2)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子。
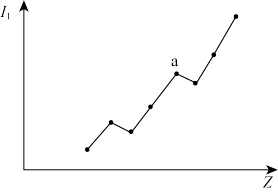
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是_______ 。原子核对外层电子的引力增大,导致I1在a点出现齿峰的原因是_______ 。
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是_______ 。
②NH3、PH3、AsH3中沸点最高的是_______ ,其主要原因是_______ 。
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是

您最近一年使用:0次
2021-05-11更新
|
128次组卷
|
2卷引用:福建省晋江市磁灶中学等校2022-2023学年高三上学期期中联考化学试题
名校
解题方法
4 . 现有四种元素,其中两种元素基态原子的电子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3,另两种元素的价电子排布式为③2s22p3④2s22p5,则下列有关比较中正确的是
| A.原子半径:①>②>④>③ | B.第一电离能:④>③>②>① |
| C.电负性: ④>③>②>① | D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2021-05-08更新
|
173次组卷
|
2卷引用:福建省福州高级中学2020-2021学年高二下学期期中考试化学试题
名校
解题方法
5 . 下列有关化学用语表述或性质比较正确的是
A.基态氧原子核外价电子排布轨道表示式 |
| B.磷化铜(Cu3P2)用于制造磷青铜,电负性:Cu<P |
C.用原子轨道描述氢分子中化学键的形成: |
D.在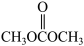 分子中, C 原子和O 原子均为 sp3杂化 分子中, C 原子和O 原子均为 sp3杂化 |
您最近一年使用:0次
2021-04-05更新
|
793次组卷
|
7卷引用:福建省南平市高级中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
6 . 我国科学家团队采用自激发缺陷诱导的方法获得白光,合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2。
(1)基态50Sn原子的价电子排布式为______ 。Ba、Sn、O三种元素的电负性由大到小的顺序为______ 。
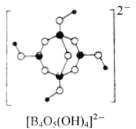
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为______ ;硼砂中存在的作用力有______ (填标号)。
a.氢键 b.离子键 c.共价键 d.配位键
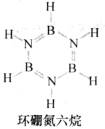
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是______ 。
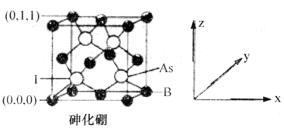
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3。(列出含a、NA的计算式即可)。
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为

a.氢键 b.离子键 c.共价键 d.配位键
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是

(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
2021-02-04更新
|
274次组卷
|
2卷引用:福建省厦门双十中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 磷化铜(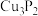 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是
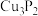 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是A. 中心原子的杂化方式为 中心原子的杂化方式为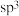 |
| B.电负性:Cu<P |
C.熔沸点: > > |
D.基态Cu原子的价电子轨道表示式为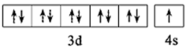 |
您最近一年使用:0次
2021-02-02更新
|
365次组卷
|
4卷引用:福建省莆田第二十五中学2023-2024学年高二下学期期中考试化学试题
8 . 现有两种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
| A.未成对电子数:①>② | B.原子半径大小:①>② |
| C.电负性大小:②>① | D.第一电离能大小:②>① |
您最近一年使用:0次
2021-01-29更新
|
206次组卷
|
3卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
解题方法
9 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: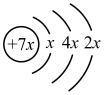 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(3)D的氢化物比C的氢化物的沸点高,原因____________________ 。
(4)E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(5)B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)D的氢化物比C的氢化物的沸点高,原因
(4)E元素在周期表的第
(5)B、C最高价氧化物的晶体类型是分别是
您最近一年使用:0次
10 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为____________ 。
(2)A、B、C三种元素电负性由大到小的顺序为_____________ (用元素符号表示),第一电离能D______ Al(填“>”“<”或“=”),其原因是______________________ 。
(3)E3+的离子符号为________________ 。
(4)F元素基态原子的电子排布式为________________ 。
(5)G元素可能的性质_______________ 。
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
(1)G的元素名称为
(2)A、B、C三种元素电负性由大到小的顺序为
(3)E3+的离子符号为
(4)F元素基态原子的电子排布式为
(5)G元素可能的性质
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
您最近一年使用:0次
2020-08-08更新
|
126次组卷
|
2卷引用:福建省三明第一中学2019-2020学年高二下学期期中考试化学试题



