名校
1 . 下列说法错误的是
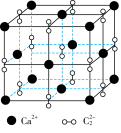
| A.CO2与SiO2的键角相等 |
| B.SiH4、CO2均是由极性键构成的非极性分子 |
| C.HCNO中元素的电负性:O>N>C>H |
| D.CaC2晶胞如图所示,Ca2+的配位数为6 |
您最近一年使用:0次
名校
2 . 某电池的电解液部分微观结构如图,“---”表示微粒间存在较强静电作用。M、N、W、X、Y、Z为原子序数依次增大的短周期元素。下列说法错误的是
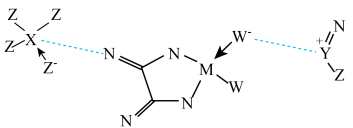
A.未成对电子数: | B.电负性: |
C.最简单氢化物的沸点: | D.熔点: |
您最近一年使用:0次
2024-03-07更新
|
342次组卷
|
2卷引用:福建省福州第二中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
3 . 一种由W、X、Y、Z、Q五种短周期主族元素组成的离子结构如图所示,其中X、Q同主族,Y的基态原子s轨道电子数是p轨道的2倍,且W、X、Z原子序数之和为15.下列说法正确的是
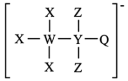
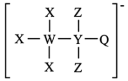
A.电负性: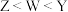 |
B.最高价氧化物对应水化物的酸性: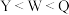 |
C.阴离子还原性: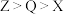 |
| D.X与Z形成的化合物沸点一定高于Y与Z形成的化合物沸点 |
您最近一年使用:0次
解题方法
4 . 四种短周期主族元素在元素周期表中的相对位置如图所示,且X、Y、Z和Q四种元素的p轨道电子总数为24。化学家鲍林以Y的电负性作为参照标准,得出了各元素的电负性。下列叙述错误的是
| X | Y | |||
| Z | Q |
| A.最简单氢化物的稳定性:Y>Q>Z |
B. 分子中每个原子最外层都达到8电子稳定结构 分子中每个原子最外层都达到8电子稳定结构 |
| C.最高价氧化物对应水化物的酸性: Z<Q |
D.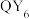 分子呈正八面体形 分子呈正八面体形 |
您最近一年使用:0次
2023-10-28更新
|
337次组卷
|
2卷引用:福建省宁德市部分达标学校2023-2024学年高三上学期期中考试化学试题
名校
5 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
144次组卷
|
5卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
名校
6 . Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如图。
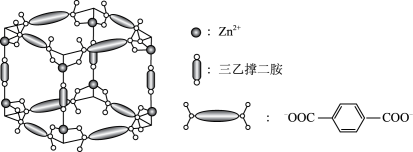
(1)Zn2+的价层电子排布式是_____ 。
(2)C、N、O的电负性从大到小 的顺序是_____ ;C、N、O的第一电离能从大到小 的顺序是_____ 。
(3)三乙撑二胺(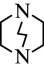 )与
)与 能形成配位键的原因是
能形成配位键的原因是_____ 。
(4)下列事实可用“水分子间存在氢键”解释的是_____ (填字母序号 )。
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(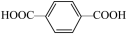 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为_____ ,羧基上碳原子的杂化方式为____ ,对苯二甲酸中最多有_____ 个原子共平面。

(1)Zn2+的价层电子排布式是
(2)C、N、O的电负性
(3)三乙撑二胺(
 )与
)与 能形成配位键的原因是
能形成配位键的原因是(4)下列事实可用“水分子间存在氢键”解释的是
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(
 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为
您最近一年使用:0次
7 . Ⅰ.已知A、B、C、D、E、F、G、H8种短周期元素的原子半径和某些化合价如下表所示:
(1)将D、F两种元素的元素符号填入如图所示元素周期表中的相应位置_______ 。
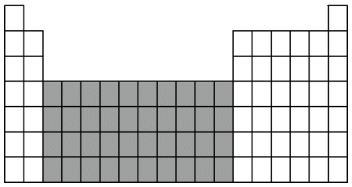
(2)上图中阴影部分所示区域的元素称为_______ 元素,下列元素属于该区域的是_______ 。
A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(3)G2D2的电子式为_______ 。(D、G为字母代号,请将字母代号用元素符号表示,下同)。
(4)某同学推断E元素基态原子的核外电子轨道表示式为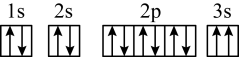 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了_______ ,该元素的I3远远大于I2,其原因是_______ 。
(5)D、E、F三种元素的简单离子半径由大到小的顺序是_______ 。
(6)H位于元素周期表中_______ 区(按电子排布分区),其基态原子的价电子排布式为_______ 。与元素H位于同一周期,其原子基态时未成对电子数在同周期中最多的元素是_______ (填元素符号)。
(7)写出一种由A、B、C、D四种元素组成离子化合物_______ 。
(8)GeO2不能形成类似CO2分子中的π键,原因是_______ 。
| 元素 | A | B | C | D | E | F | G | H |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 | +7、-1 | +4、-4 |
| 原子半径/nm | 0.073 | 0.075 | 0 077 077 | 0.102 | 0 130 130 | 0.154 | 0 099 099 | 0.111 |

(2)上图中阴影部分所示区域的元素称为
A.Ba B.Fe C.Br D.Rb
Ⅱ.现有A、B、C、D、E、F、G、H元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p能级电子数比s能级电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
| E元素的气态基态原子的第一至第四电离能分别是I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第8列 |
(4)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了(5)D、E、F三种元素的简单离子半径由大到小的顺序是
(6)H位于元素周期表中
(7)写出一种由A、B、C、D四种元素组成离子化合物
(8)GeO2不能形成类似CO2分子中的π键,原因是
您最近一年使用:0次
名校
解题方法
8 . 翡翠是玉石中的一种,其主要成分为NaAlSi2O6,常含微量Cr、Ni、Mn、Fe、Mg等元素,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一。
(1)基态硅原子的核外电子排布式为___________________ 。
(2)NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________ (写电子式)。
(3)硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有_______ ;Si2H4分子的空间构型是___________ 。
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:_________
(5)已知某FeSO4·xH2O的结构如图所示。
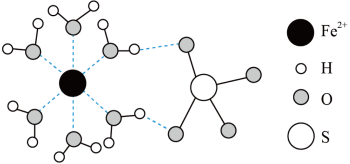
粒子内部的键角SO
_______ H2O(填“>”“<”或“=”),从杂化类型及斥力大小角度说明判断的理由:_______________ 。
(6)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式。
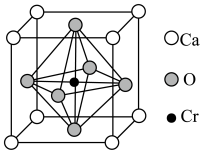
①该晶体的化学式为_______ 。
②已知钙离子、氧离子半径分别为100pm、140pm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________ pm。
(1)基态硅原子的核外电子排布式为
(2)NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是
(3)硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:
(5)已知某FeSO4·xH2O的结构如图所示。

粒子内部的键角SO

(6)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式。

①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
名校
解题方法
9 . 中国科学家首次在月球上发现新矿物,将其命名为“嫦娥石”,“嫦娥石”中包含了Fe、Cu、Ti、Cr、Ni、Mo、N、O等多种元素。
(1)鉴定月球土壤的元素组成,可采用的方法是___________ 。
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是___________ 。氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填序号)。
A.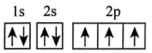 B.
B.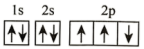
C.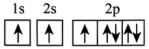 D.
D.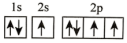
(3)已知有关氮、磷的单键和三键的键能( )如下表:
)如下表:
从能量角度看,氮以 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为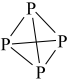 )形式存在的原因是
)形式存在的原因是___________ 。
(4)已知 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:___________
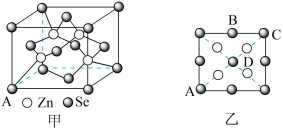
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为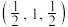 ,则D原子坐标为
,则D原子坐标为___________ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为_________________ 。
(1)鉴定月球土壤的元素组成,可采用的方法是
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是
A.
 B.
B.
C.
 D.
D.
(3)已知有关氮、磷的单键和三键的键能(
 )如下表:
)如下表:| N-N |  | P-P |  |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以
 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是(4)已知
 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为
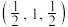 ,则D原子坐标为
,则D原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为
您最近一年使用:0次
10 . 回答下列问题:
(1)下列现象与原子核外电子跃迁有关的是___________ (填序号)。
a.焰火 b.LED灯光 c.金属导电
(2)在周期表中,与Li的化学性质最相似的邻族元素是___________ 。
(3)硼、钛等元素的化合物具有广泛的应用价值。
①B原子中存在未成对电子的能级电子云在空间有___________ 种伸展方向。
② (硼氢化钛)可由
(硼氢化钛)可由 和
和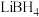 反应制得。基态钛原子的价层电子轨道表示式为
反应制得。基态钛原子的价层电子轨道表示式为___________ 。电负性大小顺序为H___________ B(填“>”或“<”)。
(4)氮单质及其化合物在研究和生产中有着广泛的应用。
①亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到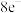 结构,则其电子式为
结构,则其电子式为___________ ,其水解会生成两种酸,写出水解的化学方程式___________ 。
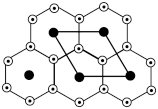
②氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为___________ ;
(1)下列现象与原子核外电子跃迁有关的是
a.焰火 b.LED灯光 c.金属导电
(2)在周期表中,与Li的化学性质最相似的邻族元素是
(3)硼、钛等元素的化合物具有广泛的应用价值。
①B原子中存在未成对电子的能级电子云在空间有
②
 (硼氢化钛)可由
(硼氢化钛)可由 和
和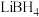 反应制得。基态钛原子的价层电子轨道表示式为
反应制得。基态钛原子的价层电子轨道表示式为(4)氮单质及其化合物在研究和生产中有着广泛的应用。
①亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到
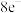 结构,则其电子式为
结构,则其电子式为②氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为

您最近一年使用:0次



