名校
1 . 某食品添加剂的主要成分为WZ(RY4)2·12X2Y。已知X、Y、Z、R、W为原子序数依次增大的前20号元素,X、Z的周期序数等于主族序数,Y和R位于同主族,基态X、W原子最外层电子排布式为ns1。下列叙述正确的是
| A.原子半径:W>R>Z>Y> X |
| B.电负性:Y>R>X>Z> W |
| C.常温下,Z、W单质都能与水发生置换反应 |
| D.R的最高价氧化物对应水化物一定有强氧化性 |
您最近一年使用:0次
2023-08-16更新
|
256次组卷
|
2卷引用:江西省部分学校(稳派)2023-2024学年高三上学期8月模拟预测化学试题
名校
2 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量含氧橄榄石矿物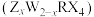 。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料。其态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料。其态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
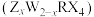 。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料。其态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料。其态Z原子核外s,p能级上电子总数相等。下列叙述正确的是A.电负性: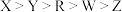 | B.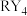 分子的键角为 分子的键角为 |
C.简单氢化物的稳定性: | D.熔点: |
您最近一年使用:0次
2023-07-22更新
|
272次组卷
|
2卷引用:江西省2024届高三第一次大联考模拟预测化学试题
3 . CuO、Cu2S等含铜化合物可以催化合成HCOOH.回答下列问题:
(1)基态铜原子的价电子排布式为___________ 。
(2)HCOOH中碳原子的轨道杂化类型为___________ ,元素电负性从大到小的顺序为___________ 。
(3)催化过程中可能产生 ,
, 的空间构型为
的空间构型为___________ ,碳氧键的平均键长 比CH3OH要
比CH3OH要___________ (填“长”或“短”)。
(4)在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是___________ 。
(5)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。
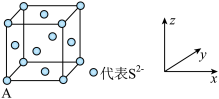
S2-配位数为______________________ ;已知图中A处(S2-)的原子分数坐标为(0,0,0),则晶胞中与A距离最近的为Cu+原子分数坐标为___________ ;若晶胞参数anm,晶体的密度为dg·cm-3),则阿伏加德罗常数的值为___________ (用含a和d的式子表示)。
(1)基态铜原子的价电子排布式为
(2)HCOOH中碳原子的轨道杂化类型为
(3)催化过程中可能产生
 ,
, 的空间构型为
的空间构型为 比CH3OH要
比CH3OH要(4)在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是
(5)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。

S2-配位数为
您最近一年使用:0次
解题方法
4 . 硫、锌分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
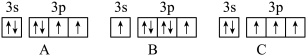
(1)基态硫原子的价电子排布式为___________ ,共有___________ 个未成对电子。下列状态的硫原子中,电离最外层1个电子所需能量最低的是___________ (填标号)。
(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因___________ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有___________ ,下表是2种二烃基锌的沸点数据,则烃基R1是___________ ,推断的依据,是___________ 。
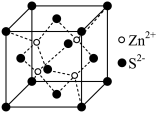
(4)闪锌矿硫化锌的晶胞结构如图所示。硫离子呈立方最密堆积,Zn2+填入S2-组成___________ 空隙中(填“正四面体”或“正八面体”);NA为阿伏加德罗常数,若晶体的密度为ρg/cm3,则S2-离子之间最短核间距离为___________ pm(用含ρ、NA的代数式表示)。
(1)基态硫原子的价电子排布式为

(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(°C) | 46 | 118 |

您最近一年使用:0次
2023-03-14更新
|
775次组卷
|
3卷引用:江西省景德镇市2023届高三下学期第二次综合模拟考试理综化学试题
5 . W、X、Y、Z、M是构成离子液体的五种短周期不同主族元素,原子序数依次增大且只有一种元素与其他元素不在同一周期。离子液体被广泛应用于有机合成、分离提纯以及电化学研究中。离子液体的结构如图所示。下列有关说法错误的是
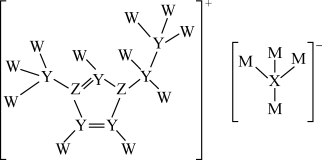

| A.Y的氢化物常温下为气体 |
| B.元素W与X形成的化合物中W显负价 |
| C.Z的最高价含氧酸能与其对应的简单氢化物反应 |
| D.由W、Z、M元素可形成同时含有离子键和共价键的化合物 |
您最近一年使用:0次
2022-05-05更新
|
537次组卷
|
3卷引用:江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题31 元素推断的破解-备战2023年高考化学一轮复习考点微专题湖南省株洲市十三中2022-2023学年高三第五次月考化学试题
名校
解题方法
6 . 以物质的量之比3:1的Fe和Al共熔后结晶得Fe3Al晶体,晶胞结构如图一所示,该晶胞为立方晶胞,晶胞参数为a pm。血红素(如图二)是血红蛋白的活性部位,其中心元素是Fe( II)。二者是常见的含铁物质,请回答下列问题。
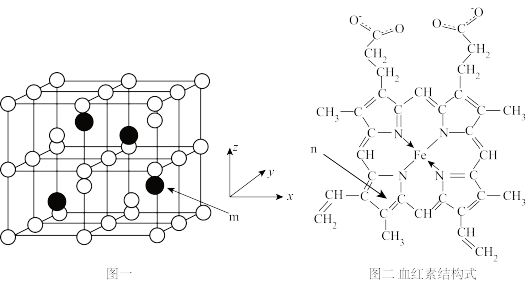
(1)Fe2+的价电子排布式为:_______ 。
(2)血红素分子中非金属元素电负性由大到小的顺序是_______ (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是_______ (用化学式表示);C、N、O三种元素形成一种阴离子CNO-,其结构中有_______ 个σ键,_______ 个π键。
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为_______ ;该环_______ (填“有”、“无”)芳香性。
(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为_______ (以含π的代数式表示)。
(5)m原子的原子分数坐标为_______ . ;晶胞内任意两个A1原子之间的距离为_______ pm。
(6)Fe3Al晶体的密度为_______ g·cm-3。

(1)Fe2+的价电子排布式为:
(2)血红素分子中非金属元素电负性由大到小的顺序是
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3
 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为
(5)m原子的原子分数坐标为
(6)Fe3Al晶体的密度为
您最近一年使用:0次
2022-04-29更新
|
635次组卷
|
3卷引用:江西省九江市2021届高三三模考试化学试题
名校
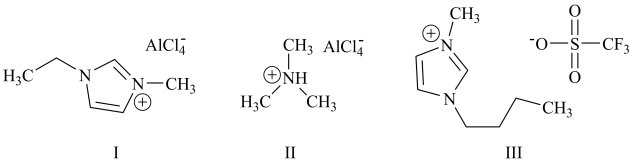
7 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.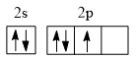 | B.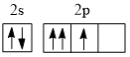 | C.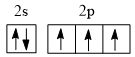 | D.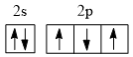 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
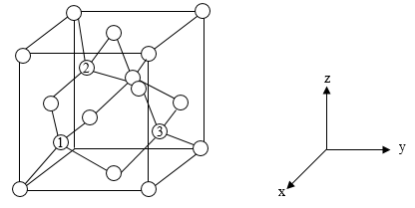
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2776次组卷
|
10卷引用:江西省新余市2022届高三第二次模拟考试理综化学试题
江西省新余市2022届高三第二次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)广东省广州市2022届高三一模考试(结构与性质)(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
解题方法
8 . 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:
(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是_______ ,其原子中的未成对电子数为_______ 。
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为_______ ,其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为_______ 。
(3)第一电离能P_______ Cl (填“大于”或“小于”),PPh3是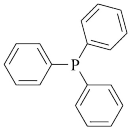 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是_______ 。比较PPh3与PH3的沸点大小,并说明原因_______ 。
(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
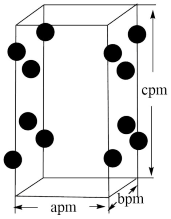
①晶胞中含有的Cl-数目为_______ ;
②若阿伏加德罗常数为NA,则晶体的密度为_______ g·cm-3.(列出计算式)
 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为
(3)第一电离能P
 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):

①晶胞中含有的Cl-数目为
②若阿伏加德罗常数为NA,则晶体的密度为
您最近一年使用:0次
2021-05-31更新
|
261次组卷
|
2卷引用:江西省新余市2023届高三下学期第二次模拟考试理科综合化学试题
解题方法
9 . 最近我国科研人员成功攻克了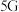 通信芯片制造中关键材料氮化镓
通信芯片制造中关键材料氮化镓 的研制难题.已知元素镓
的研制难题.已知元素镓 与
与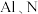 与
与 分别是同主族的元素,请回答下列问题:
分别是同主族的元素,请回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为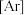
_________ 。
(2)根据元素周期律,元素的电负性
________ (填“大于”或“小于”,下同) ;
;
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于________ 晶体。
(4) 是氮的氢化物,中心原子的杂化方式是
是氮的氢化物,中心原子的杂化方式是_________ , 的沸点比
的沸点比 高的原因是
高的原因是_______ 。
(5) 可采用
可采用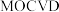 (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与
(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为:
和另一种产物,该过程的化学方程式为:____________________________ 。
(6)原子晶体 的晶胞参数
的晶胞参数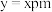 ,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为_________ ;紧邻的 原子之间的距离为a,紧邻的
原子之间的距离为a,紧邻的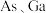 原子之间的距离为b,则
原子之间的距离为b,则
_________ .该晶胞的密度为__________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
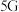 通信芯片制造中关键材料氮化镓
通信芯片制造中关键材料氮化镓 的研制难题.已知元素镓
的研制难题.已知元素镓 与
与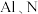 与
与 分别是同主族的元素,请回答下列问题:
分别是同主族的元素,请回答下列问题:(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为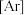
(2)根据元素周期律,元素的电负性

 ;
;(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(4)
 是氮的氢化物,中心原子的杂化方式是
是氮的氢化物,中心原子的杂化方式是 的沸点比
的沸点比 高的原因是
高的原因是(5)
 可采用
可采用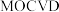 (金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与
(金属有机物化学气相淀积)技术制得:以合成的三甲基镓为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为:
和另一种产物,该过程的化学方程式为:(6)原子晶体
 的晶胞参数
的晶胞参数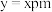 ,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为 原子之间的距离为a,紧邻的
原子之间的距离为a,紧邻的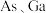 原子之间的距离为b,则
原子之间的距离为b,则
 (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
您最近一年使用:0次
名校
10 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
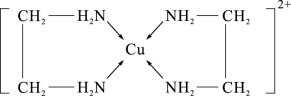
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
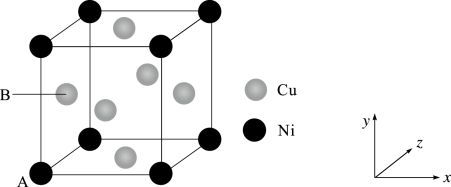
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
988次组卷
|
6卷引用:江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题
江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2022届江西省赣州市高三适应性考试(二模)理综化学试题安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题2021年山东高考化学试题变式题11-20(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)



