2011·江西·一模
名校
解题方法
1 . 已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________________________ ,Y元素原子最外层电子的电子排布图为:____________ 。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________ (填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________ 形,中心原子的轨道杂化类型为__________ ,分子为______________ (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________ 。
(5)该化合物的沸点与SiCl4比较:________ (填化学式)的高,原因是__________________________ 。
(1)X元素的原子基态时电子排布式为:
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为
(3)该化合物的空间结构为
(4)该化合物在常温下为液体,该液体微粒间的作用力是
(5)该化合物的沸点与SiCl4比较:
您最近一年使用:0次
2019-04-27更新
|
401次组卷
|
15卷引用:2011届江西省八所重点中学联合考试高三(理综)化学部分
(已下线)2011届江西省八所重点中学联合考试高三(理综)化学部分【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷河北省秦皇岛市卢龙县2016-2017学年高二下学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:2.3 分子的性质(第2课时)贵州省息烽县一中2018-2019学年高二11月份考试化学试题云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题贵州省从江县第一民族中学2018-2019学年高二上学期期末考试化学试题云南省玉溪市江川二中2018-2019学年高二下学期5月份考试化学试题云南省昭通市永善县第二中学2019—2020学年高二上学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题(已下线)第二章 分子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
2 . 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________ ,3d能级上的未成对电子数为_________ ,能量最高能级的电子云形状为_________ 。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________ ,写出一个与SCN-具有相同空间构型的分子:_________ 。
(3)氮元素的最简单氢化物为氨,氨的沸点_________ (填“高于”或“低于”)膦(PH3),原因是_________ 。氮元素另一种氢化物联氨(N2H4)是_________ (填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________ 。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________ 。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________ 。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________ g/cm3(设阿伏伽德罗常数的值为NA)。
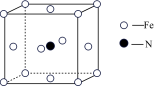
(1)铁元素基态原子的电子排布式为
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为
(3)氮元素的最简单氢化物为氨,氨的沸点
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:

您最近一年使用:0次
名校
3 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
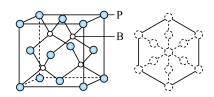
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2518次组卷
|
8卷引用:江西省上饶市2020届第一次高考模拟考试理科综合化学试题
江西省上饶市2020届第一次高考模拟考试理科综合化学试题【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题2020年全国卷Ⅰ理综化学高考真题变式题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题(已下线)2020年海南卷化学高考真题变式题15-19河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
2011·江西抚州·一模
4 . 下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)写出上表中元素⑨原子的基态原子核外电子排布式为___________________ 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为_____ 杂化;元素⑦与⑧形成的化合物的晶体类型是___________ 。
(3)元素④的第一电离能______ ⑤(填写“>”、 “=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________ 。请写出与元素④的单质互为等电子体分子、离子的化学式______________________ (各写一种)。
(4)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为_______________ 。
(5)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________ 。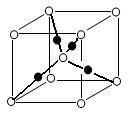

(1)写出上表中元素⑨原子的基态原子核外电子排布式为
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
(3)元素④的第一电离能
(4)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为
(5)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为

您最近一年使用:0次
名校
5 . 由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为____ 个,能量最高的电子占据的能级符号为__ 。
(2)磷的一种同素异形体—白磷(P4)的立体构型为____ ,推测其在CS2中的溶解度____ (填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________ 。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______ 。
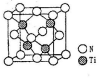
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____ ,已知晶体的密度为pg·cm-3,阿伏伽德罗常数为NA,则晶胞边长为____ cm(用含p、NA的式子表示)。
(1)钛元素基态原子未成对电子数为
(2)磷的一种同素异形体—白磷(P4)的立体构型为
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为

您最近一年使用:0次
2018-05-28更新
|
297次组卷
|
4卷引用:江西省南昌市2018届高三第二次模拟考试理科综合化学试题
江西省南昌市2018届高三第二次模拟考试理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题18 物质结构与性质(选修)广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题2020届高三化学二轮选修大题必练— —— 物质结构与性质
解题方法
6 . 铁、钻、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)基态钴原子的价电子排布式为________ ,铁、钴、镍的基态原子核外未成对电子数最少的是_____________
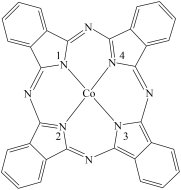
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是__________ (填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____ (用相应的元素符号表示);碳原子的杂化轨道类型为_________
(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO) x晶体属于_______ (填晶体类型),若配合物Fe(CO) x的中心原子价电子数与配体提供电子数之和为18,则x=_________
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“>”“<”或“=”),原因是___________________________ 。
(5)NiAs的晶胞结构如图所示:
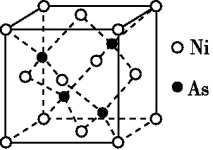
①镍离子的配位数为_________ 。
②若阿伏伽德罗常数的值为NA,晶体密度为pg.cm-1,则该晶胞中最近的离子之间的距离为_____ cm。(写出计算表达式)
(1)基态钴原子的价电子排布式为
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO) x晶体属于
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(5)NiAs的晶胞结构如图所示:

①镍离子的配位数为
②若阿伏伽德罗常数的值为NA,晶体密度为pg.cm-1,则该晶胞中最近的离子之间的距离为
您最近一年使用:0次
名校
解题方法
7 . 氮族元素和硼族元素在生产生活中有很重要的地位。
(1)写出硼族元素Ga的基态原子核外电子排布式_________________ 。
(2)NF3的分子构型为__________ ,NO3-的空间构型为______ ,1molNO3-中含有的σ键的数目为:_________ 。
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式________ 。
(4)元素第一电离能的大小:As______ (填“”或“=”)Ga,原因是__________ 。
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是__________ 。
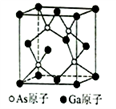
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为________ ,晶胞中As原子和它最近的Ga原子之间的距离为_______ pm(用含c的式子表示),砷化镓的密度为_______ g/cm3(设NA为阿伏伽德罗常数的值,用含c、NA的式子表示,原子量:Ga-70,As-75)。
(1)写出硼族元素Ga的基态原子核外电子排布式
(2)NF3的分子构型为
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式
(4)元素第一电离能的大小:As
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为

您最近一年使用:0次
名校
解题方法
8 . [化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为_____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
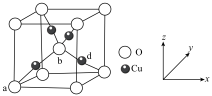
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为____________ ,已知该晶体的密度为ρg/cm3,NA是阿伏伽德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为
(2)MgO的熔点高于CuO的原因是
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为

您最近一年使用:0次
2018-01-12更新
|
552次组卷
|
4卷引用:江西省兴国中学2019届高三下学期第二次综合测试(二)理科综合化学试题
解题方法
9 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为_______ 。
(2)纳米TiO2常用作下述反应的催化剂。
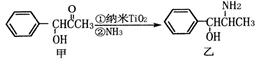
化合物甲的分子中采取sp2方式杂化的碳原子有_______ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为_______ 。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是_______ ,1 mol该配合物中含有的 键数目是
键数目是_______ 。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_______ 。
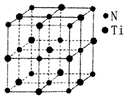
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_______ 个:Ti原子的配位数为_______ ;此配位原子构成的空间构型为_______ ;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为_______ g·cm-3、NA为阿伏伽德罗常数的值,只列计算式)。
请回答下列问题:
(1)Ti的基态原子价电子排布式为
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是
 键数目是
键数目是(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有

您最近一年使用:0次
2017-04-13更新
|
295次组卷
|
2卷引用:2017届江西省南昌市十所省重点中学命制高三第二次模拟突破冲刺(一)理综化学试卷
解题方法
10 . 太阳能电池板材料除单品硅外,还有铜、铟、稼、硒、硅等化学物质。
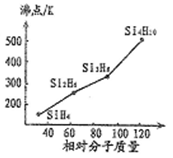
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____ Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷(SinH2n+2)。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是______________ 。
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________ 。
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________________ 。
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度_____ g/cm3。
(3)稼的基态原子的电子排布式是_______ 。与铟、稼元家处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物.如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______ ,B与N之间形成______ 键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.其电离方程式为______________ 。
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度
(3)稼的基态原子的电子排布式是
您最近一年使用:0次



