1 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)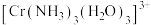 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
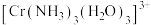 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近一年使用:0次
2024-02-01更新
|
270次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
2 . 基于所学内容回答问题
(1)基态铜原子的价电子排布式为_________ ,其核外电子的空间运动状态有________ 种;As原子的价电子排布图为________________ 。
(2) 与
与 同周期,
同周期,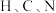 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为________ ; 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为________________ 。
(3) 的电子式
的电子式_________ , 的沸点高于
的沸点高于 的原因是
的原因是_________ 。
(4)已知 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是__________________ 。
(5)铜的某种氧化物的晶胞结构如图所示,若该晶胞中 原子与
原子与 原子之间的最近距离为apm,设阿伏加德罗常数的值为
原子之间的最近距离为apm,设阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为_________  (填含
(填含 的表达式)。
的表达式)。
(1)基态铜原子的价电子排布式为
(2)
 与
与 同周期,
同周期,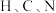 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为(3)
 的电子式
的电子式 的沸点高于
的沸点高于 的原因是
的原因是(4)已知
 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是(5)铜的某种氧化物的晶胞结构如图所示,若该晶胞中
 原子与
原子与 原子之间的最近距离为apm,设阿伏加德罗常数的值为
原子之间的最近距离为apm,设阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (填含
(填含 的表达式)。
的表达式)。 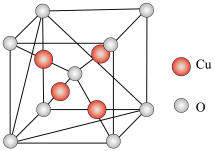
您最近一年使用:0次
2024-01-23更新
|
391次组卷
|
2卷引用:山东省聊城颐中外国语学校2023-2024学年高二下学期第一次质量检测化学试题
3 . 光伏材料是指能将太阳能直接转换成电能的材料,又称太阳电池材料,只有半导体材料具有这种功能。可作太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)已知Se在元素周期表中的位置为___________ ,硅的基态原子的电子排布式为___________ ,基态Ga原子核外电子占据的最高能级为___________ ,其轨道呈___________ 形。
(2)P、S、Ga电负性从大到小的顺序为___________ 。
(3)As元素的第一电离能___________ Se元素的第一电离能(填“大于”“小于”或“等于”),原因是___________ 。
(4)太阳电池材料中的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因是___________ 。
(1)已知Se在元素周期表中的位置为
(2)P、S、Ga电负性从大到小的顺序为
(3)As元素的第一电离能
(4)太阳电池材料中的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因是
您最近一年使用:0次
解题方法
4 . 根据要求回答下列问题:
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有___________ 种。
(2)嫦娥五号实现了我国首次地外天体采样返回,带回的月壤中包含了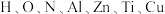 等多种元素,N的第一电离能大于O的,请说明理由:
等多种元素,N的第一电离能大于O的,请说明理由:_______ 。
(3)已知电离能: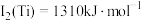 ,
,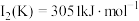 ,
,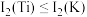 ,其原因为
,其原因为___________ 。
(4)橙红色晶体羰基钴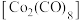 的熔点为
的熔点为 ,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为_________ (填元素符号)。配体 中
中 键与
键与 键数目之比是
键数目之比是___________ 。
(5) 中键与键之间的夹角为
中键与键之间的夹角为 ,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________ ,1个分子中含有___________ 个 键。
键。
(6)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与 互为等电子体的分子有
互为等电子体的分子有___________ 、___________ 。
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有
(2)嫦娥五号实现了我国首次地外天体采样返回,带回的月壤中包含了
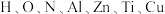 等多种元素,N的第一电离能大于O的,请说明理由:
等多种元素,N的第一电离能大于O的,请说明理由:(3)已知电离能:
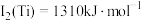 ,
,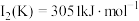 ,
,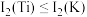 ,其原因为
,其原因为(4)橙红色晶体羰基钴
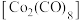 的熔点为
的熔点为 ,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为 中
中 键与
键与 键数目之比是
键数目之比是(5)
 中键与键之间的夹角为
中键与键之间的夹角为 ,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 键。
键。(6)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与
 互为等电子体的分子有
互为等电子体的分子有
您最近一年使用:0次
2023-12-15更新
|
361次组卷
|
3卷引用:2023-2024学年高二上学期期末化学考试仿真卷(一)2019版选修一、选修二(部分)
5 . 有机物种类繁多,应用广泛。
(1)邻氨基吡啶(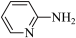 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为_______ (填元素符号)。 能溶于水的原因是
能溶于水的原因是_______ 。
(2)鸟嘌呤和吡咯的结构如下图所示。
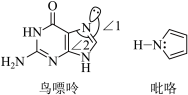
①鸟嘌呤中N原子的杂化方式为_______ ,夹角∠1_______ ∠2(填“>”或“<”)。
②分子中的大 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,吡咯中的大
键的电子数,吡咯中的大 键可表示为
键可表示为_______ 。
(3)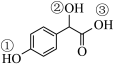 分子中3个-OH的电离能力由强到弱的顺序是
分子中3个-OH的电离能力由强到弱的顺序是_______ (用①、②、③表示)。
(4)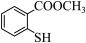 与
与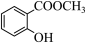 相比,前者的水溶性更
相比,前者的水溶性更_______ (填“大”或“小”)。—SH与—OH性质相似,写出与NaOH溶液反应的化学方程式_______ 。
(1)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为 能溶于水的原因是
能溶于水的原因是(2)鸟嘌呤和吡咯的结构如下图所示。

①鸟嘌呤中N原子的杂化方式为
②分子中的大
 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,吡咯中的大
键的电子数,吡咯中的大 键可表示为
键可表示为(3)
 分子中3个-OH的电离能力由强到弱的顺序是
分子中3个-OH的电离能力由强到弱的顺序是(4)
 与
与 相比,前者的水溶性更
相比,前者的水溶性更
您最近一年使用:0次
2023-07-11更新
|
355次组卷
|
2卷引用:山东省泰安市2022-2023学年高二下学期期末考试化学试题
解题方法
6 . 材料是人类文明进步的阶梯,主族非金属元素是组成特殊材料的重要元素。请回答下列问题:
(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是_____ ,第一电离能从大到小的顺序是_____ 。
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是______ (填化学式);已知等电子体具有相同的空间构型,结合价电子对互斥理论可知N2O分子为______ 形。
(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是_____ (填符号);配合物T与[M(NH3)5(H2O)]Cl3组成所含微粒种类和数目相同,中心离子的配位数相同且T中也只有两种配体,若1molT溶于水,加入足量AgNO3溶液只生成2molAgCl,则T的配合物可表示为_____ 。
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为_____ 。

(1)氮氧共掺杂多孔碳材料是一种新型高效的能源存储材料,其中的三种主要元素C、N、O,电负性从小到大的顺序是
(2)根据杂化轨道理论的相关知识,在NH3、BF3、SO
 、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是
、H3O+几种微粒中,中心原子杂化方式与其他三个不同的是(3)有一种配合物组成为[M(NH3)5(H2O)]Cl3,该配合物中提供孤电子对的原子是
(4)最近发现一种由Ti原子和C原子构成的气态团簇分子如图所示,其化学式为

您最近一年使用:0次
解题方法
7 . 绿色植物是利用空气中的CO2、阳光、泥土中的水分及矿物质为自己制造食物,整个过程被称为“光合作用”,而所需的阳光被叶子内的绿色物质吸收,这种绿色有机化合物就是叶绿素,叶绿素a的结构如图所示:
(1)叶绿素a中含氧官能团的名称为_____ 。
(2)有关叶绿素a的结构与性质,下列说法中正确的是_____ 。
A.叶绿素a中碳原子杂化方式只有sp2一种
B.叶绿素a易溶于水、乙醚、乙醇等溶剂
C.叶绿素a能使酸性KMnO4溶液褪色
(3)叶绿素a的组成元素中电负性由大到小依次为_____ (用元素符号表示)。
(4)叶绿素a光解后会产生乳酸、柠檬酸等酸性物质。有机酸羧酸的电离方程式为R-COOH R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为
R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为_____ 。
(5)在植物体内还有一类物质吲哚乙酸也能刺激植物生长,使植物具有向光性,其结构如图所示:_____ 。
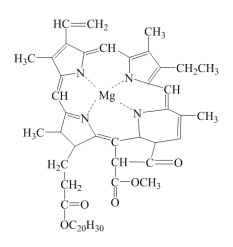
(1)叶绿素a中含氧官能团的名称为
(2)有关叶绿素a的结构与性质,下列说法中正确的是
A.叶绿素a中碳原子杂化方式只有sp2一种
B.叶绿素a易溶于水、乙醚、乙醇等溶剂
C.叶绿素a能使酸性KMnO4溶液褪色
(3)叶绿素a的组成元素中电负性由大到小依次为
(4)叶绿素a光解后会产生乳酸、柠檬酸等酸性物质。有机酸羧酸的电离方程式为R-COOH
 R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为
R-COO-+H+,其电离产生的羧酸根负离子越稳定,其相应的羧酸的酸性越强,影响羧酸根负离子稳定性的因素主要是R基团的电子效应,R基团上连有吸电子基时其酸性增强;R基团上连有供电子基时其酸性减弱。已知甲基是供电子基,卤素的吸电子效应-F>-Cl>-Br>-I,则CH3COOH、CH2FCOOH、CH2ClCOOH的酸性由强到弱依次为(5)在植物体内还有一类物质吲哚乙酸也能刺激植物生长,使植物具有向光性,其结构如图所示:
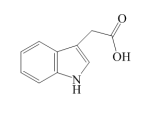
您最近一年使用:0次
2023-03-17更新
|
222次组卷
|
2卷引用:山东省学情2022-2023学年高二下学期3月联考化学试题
解题方法
8 . 2022年央视春晚的舞蹈剧《只此青绿》灵感来自北宋卷轴画《千里江山图》,该卷长11.91米,颜色绚丽,由石绿、雌黄、赭石、砗磲、朱砂等颜料绘制而成。颜料中经常含有铜、锌、钛、铁等元素。
(1)写出Zn所在元素周期表中的分区是_______ 区;基态Ti原子的价电子排布式_______ ;基态 核外电子的空间运动状态有
核外电子的空间运动状态有_______ 种,基态铁原子处在最高能层的电子的电子云形状为_______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_______ 。
(3)一种新研发出的铁磁性材料M的分子结构如图所示。
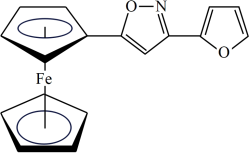
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中 共提供6个杂化轨道,则铁原子可能的杂化方式为
共提供6个杂化轨道,则铁原子可能的杂化方式为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(1)写出Zn所在元素周期表中的分区是
 核外电子的空间运动状态有
核外电子的空间运动状态有(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)一种新研发出的铁磁性材料M的分子结构如图所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中
 共提供6个杂化轨道,则铁原子可能的杂化方式为
共提供6个杂化轨道,则铁原子可能的杂化方式为A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
9 . W、X、Y、Z、M是原子序数依次增大的前四周期元素,其元素性质或结构如下:
回答下列问题:
(1)写出X元素的名称_______ 。
(2)写出M元素+2价离子的价电子轨道表示式_______ 。
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为_______ 。
(4)W、X、Z可形成强还原性物质 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是_______ (用元素符号表示)。
(5)大π键可用符号 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键_______ ,某化合物XY的结构(见下图b)中也存在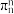 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因_______ 。

| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 核外只有一个未成对电子,且电子有三种空间运动状态 |
| Y | s轨道电子数比p轨道多一个,且第一电离能大于同周期相邻元素 |
| Z | 电负性是短周期中最小的 |
| M | +3价基态离子最高能级处于半满状态 |
(1)写出X元素的名称
(2)写出M元素+2价离子的价电子轨道表示式
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为
(4)W、X、Z可形成强还原性物质
 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是(5)大π键可用符号
 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作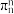 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键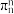 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
您最近一年使用:0次
2023-02-23更新
|
643次组卷
|
2卷引用:山东省潍坊市2022-2023学年高二上学期期末考试化学试题
解题方法
10 . 亚铁氰化钾( )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(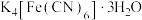 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(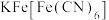 )。回答下列问题。
)。回答下列问题。
(1)O元素位于_______ 区,基态O原子核外电子的空间运动状态有_______ 种。
(2)Fe在元素周期表中的位置_______ ,基态Fe原子的价电子轨道表示式为_______ 。
(3)黄血盐(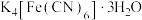 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是_______ ,该原子能量最高的电子所在能级符号为_______ 。
(4)亚铁氰化钾( )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为_______ 。
(5)普鲁士蓝(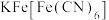 )中不同价态铁元素的简单微粒较稳定的是
)中不同价态铁元素的简单微粒较稳定的是_______ ,其原因是_______ 。
 )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(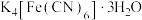 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(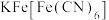 )。回答下列问题。
)。回答下列问题。(1)O元素位于
(2)Fe在元素周期表中的位置
(3)黄血盐(
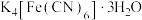 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是(4)亚铁氰化钾(
 )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为(5)普鲁士蓝(
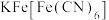 )中不同价态铁元素的简单微粒较稳定的是
)中不同价态铁元素的简单微粒较稳定的是
您最近一年使用:0次



