1 . 按要求作答
(1)钴位于元素周期表的第__ 族,其基态原子中未成对电子个数为__ 。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__ ,所含非金属元素的电负性由大到小的顺序是__ 。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__ 。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__ Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__ 。
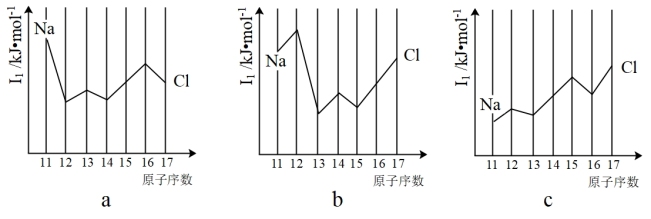
A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
您最近一年使用:0次
2020-01-10更新
|
883次组卷
|
4卷引用:化学预测卷(八)-预测卷(浙江专版)
名校
2 . 向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____ 区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____ 。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____ (用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____ (用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____ 杂化;SO42-离子的立体构型是____ ,写出与SO42-互为等电子体的一种离子____ 。
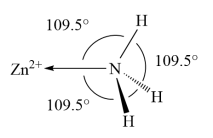
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____ 。
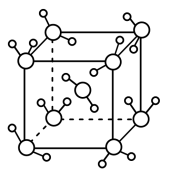
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为____ g.cm-3(只列式,不计算)。
(1)铜元素位于元素周期表中
(2)非金属元素N、O、S的第一电离能由大到小的顺序是
(3)上述深蓝色晶体中含有的元素的电负性最小的是
(4)H2O的中心原子轨道杂化类型为
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因

(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为

您最近一年使用:0次
2019-11-13更新
|
289次组卷
|
3卷引用:2019年四川省遂宁市高三零诊考试理综化学试题
3 . [化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________ ,Fe3+的基态价电子排布图为___________ 。
(2)在上述两种钾盐中第一电离能最大的元素为___________ ,电负性最小的元素为___________ 。
(3)H2C2O4分子中碳原子的杂化类型是___________ ,与C2O42-互为等电子体的分子的化学式为___________ (写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________ (用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
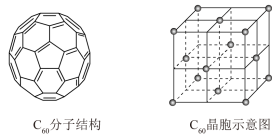
①1个C60分子中含有π键的数目为___________ 。
②晶胞中C60的配位数为___________ 。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________ g·cm-3(NA代表阿伏伽德罗常数)。
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为
(2)在上述两种钾盐中第一电离能最大的元素为
(3)H2C2O4分子中碳原子的杂化类型是
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是
(5)已知C60分子结构和C60晶胞如右图所示:

①1个C60分子中含有π键的数目为
②晶胞中C60的配位数为
③已知C60晶胞参数为apm,则该晶胞密度的表达式是
您最近一年使用:0次
2019-02-17更新
|
1204次组卷
|
2卷引用:【校级联考】安徽省合肥一中、马鞍山二中等六校教育研究会2019届高三下学期第二次联考理科综合化学试题
名校
4 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
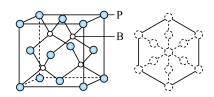
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2519次组卷
|
8卷引用:【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题
【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题江西省上饶市2020届第一次高考模拟考试理科综合化学试题2020年全国卷Ⅰ理综化学高考真题变式题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题(已下线)2020年海南卷化学高考真题变式题15-19河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
名校
解题方法
5 . 1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______ 族
(2)下列关于Ge元素叙述正确的是______ (从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作制冷剂,其键角_______ (填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________ ,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于
(2)下列关于Ge元素叙述正确的是
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是
(4)NH3也常作制冷剂,其键角
(5)图示材料的理想化学式(无空位时)为

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为
您最近一年使用:0次
解题方法
6 . (1)Fe基态原子核外电子排布式为_____________________ 。
(2)H、N、O的电负性从小到大的顺序是___________________ 。
(3)与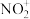 互为等电子体的一种分子为
互为等电子体的一种分子为______________ (填化学式)。
氨基(-NH2)中氮原子的杂化类型为_________________ 。
(4)1mol乙酸分子中含有σ键的数目为____________________ 。
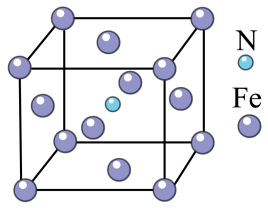
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为_______________ 。
(2)H、N、O的电负性从小到大的顺序是
(3)与
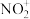 互为等电子体的一种分子为
互为等电子体的一种分子为氨基(-NH2)中氮原子的杂化类型为
(4)1mol乙酸分子中含有σ键的数目为
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为

您最近一年使用:0次
7 . 硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________ ;Be、B、Al的第一电离能由大到小的顺序是______________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______ ,与其互为等电子体的一种分子的分子式是______________ 。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________ ,Cu(NO3)2中的化学键除了σ键外,还存在_______________ 。
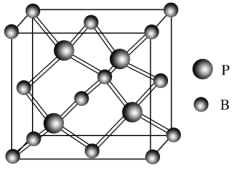
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________ ,已知该晶体的晶胞参数a pm,用NA代表阿伏伽德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________ pm。
(1)基态Cu+的核外价层电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(3)SeO32-中Se原子的杂化类型为
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为

您最近一年使用:0次
名校
8 . Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________ ,M2+的核外电子排布式为________________________ 。
(2)M2Z的熔点比M2W的_________ (填“高”或“低”) ,请解释原因___________ 。
(3)N3-和YZ2是等电子体,则N3-的结构式为_________________ 。
(4)WZ2分子中W原子价层电子对数是_____________ 对,WZ2的VSEPR 模型名称为______________________ ,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________ ;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为__________ ;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________ (填图2中字母) ,该分子中含有___ 个σ键。
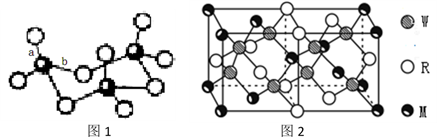
(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与_______ 个W原子相连,晶体密度ρ=_______ g/cm3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA=6.02×1023mol-1)。
| 元素 | 相关信息 |
| Y | 原子核外有6个不同运动状态的电子 |
| Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
| W | 主族元素,与Z原子的价电子数相同 |
| R | 价层电子排布式为3d64s2 |
| M | IB族,其被称作“电器工业的主角” |
(1)Z、W元素相比,第一电离能较大的是
(2)M2Z的熔点比M2W的
(3)N3-和YZ2是等电子体,则N3-的结构式为
(4)WZ2分子中W原子价层电子对数是

(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与
您最近一年使用:0次
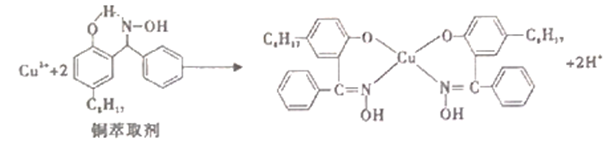
9 . 工业上常利用铜萃取剂,使溶液中的Cu2+富集进入有机相,再经过进一步的反萃取实现金属铜的沉积、再生,铜萃取剂富集Cu2+的原理如下:
(1)基态铜原子所失去的第一个电子所占据的能层符号是______ , 价铜离 子的简化电子排布式为_________ 。
(2)铜萃取剂中所含 元素的电负性由大到小顺序为______ ,N原子以_____ 杂化轨道与O原子形成σ键。
(3)铜萃取剂与 Cu2+形成的配合物在水相的溶解度______ 有机相的溶解度(填“>”、“<”、“=”),该配合物晶体类型为_____ 。
(4)某学生用硫酸铜溶液与氨水做了一组实 验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式_________ ;沉淀溶解后溶液中的阳离子内存在的化学键类型有________ 。
(5)铜的一种氯化物的晶胞如图所示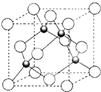 ,该氯化物的化学式
,该氯化物的化学式_____ ,Cu 和Cl之间最短距离为460.0pm,则晶体密度为______ g/cm3。(列式表示)

(1)基态铜原子所失去的第一个电子所占据的能层符号是
(2)铜萃取剂中所含 元素的电负性由大到小顺序为
(3)铜萃取剂与 Cu2+形成的配合物在水相的溶解度
(4)某学生用硫酸铜溶液与氨水做了一组实 验:CuSO4溶液
 蓝色沉淀
蓝色沉淀 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式(5)铜的一种氯化物的晶胞如图所示
 ,该氯化物的化学式
,该氯化物的化学式
您最近一年使用:0次
名校
10 . 锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________ 。
(2)基态Mn原子的价电子排布式为_________ ,未成对电子数为_____ 个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________ 。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________ 。
(6)某种含锰特殊材料的晶胞结构如下图所示:
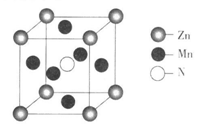
若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是
(2)基态Mn原子的价电子排布式为
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是
(6)某种含锰特殊材料的晶胞结构如下图所示:

若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
2018-05-17更新
|
388次组卷
|
2卷引用:【全国市级联考】河南省安阳市2018届高三第三次模拟考试理综化学试题



