名校
解题方法
1 . 已知A、B、C、D、E、F是原子序数依次增大的短周期元素。其中A是周期表中原子半径最小的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E元素价层电子数为2;F与D的最高能层数相同,但其价层电子数等于其电子层数。下列说法正确的是
| A.电负性比较:B>C>A | B.第一电离能比较:F>E>D |
| C.简单离子半径比较:B>C>D | D.相应化合物熔点比较:D2C>EC>BA3>A2C |
您最近一年使用:0次
2022-05-18更新
|
184次组卷
|
3卷引用:湖南省株洲市茶陵县第一中学2021-2022学年高二下学期期中考试化学试题
2 .  有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
(1)基态Co原子的价层电子排布图为_______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_______ ;C、N、O、F的第一电离能由大到小的顺序为_______ 。
(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
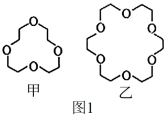
冠醚中O原子的杂化形式为_______ ;H、C、O的电负性由小到大的顺序为_______ 。
(4) 的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。

①每个晶胞中由K和F共同形成的正四面体空隙有_______ 个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于_______ 位置。
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下列问题:(1)基态Co原子的价层电子排布图为
(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

冠醚中O原子的杂化形式为
(4)
 的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
的晶胞如图2所示。处于面心的F形成正八面体空隙,Co处于体心,K处于顶点。
①每个晶胞中由K和F共同形成的正四面体空隙有
②晶胞的另一种表示中,Co处于各顶角位置,则K处于
您最近一年使用:0次
名校
解题方法
3 . 氮、磷、砷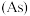 、锑
、锑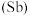 、铋
、铋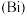 、镆
、镆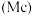 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置_______ ;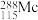 的中子数为
的中子数为_______ 。
(2)已知:
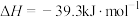

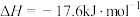
由此推知,其中最稳定的磷单质是_______ 。
(3)氮、磷、砷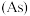 、锑
、锑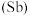 、铋
、铋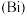 、镆
、镆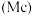 电负性依次
电负性依次_______ (增大或减小)。
(4) 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是_______ (填序号)。
a.不能与 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应
(5) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
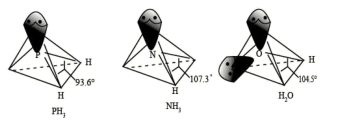
 中P的杂化类型是
中P的杂化类型是_______ ; 的键角小于
的键角小于 的,分析原因
的,分析原因_______ 。
(6)在1L真空密闭容器中加入amol 固体,t℃时发生如下反应:
固体,t℃时发生如下反应:
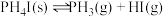 ①
①
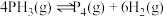 ②
②
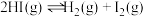 ③
③
达平衡时,体系中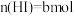 ,
, ,
,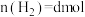 ,则t℃时反应①的平衡常数K值为
,则t℃时反应①的平衡常数K值为_______ (用字母表示)。
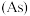 、锑
、锑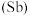 、铋
、铋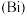 、镆
、镆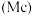 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)砷在元素周期表中的位置
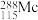 的中子数为
的中子数为(2)已知:

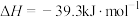

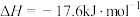
由此推知,其中最稳定的磷单质是
(3)氮、磷、砷
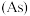 、锑
、锑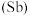 、铋
、铋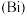 、镆
、镆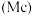 电负性依次
电负性依次(4)
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是a.不能与
 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应(5)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的,分析原因
的,分析原因(6)在1L真空密闭容器中加入amol
 固体,t℃时发生如下反应:
固体,t℃时发生如下反应: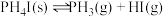 ①
①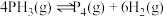 ②
②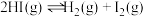 ③
③达平衡时,体系中
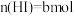 ,
, ,
,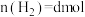 ,则t℃时反应①的平衡常数K值为
,则t℃时反应①的平衡常数K值为
您最近一年使用:0次
名校
解题方法
4 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(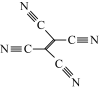 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
619次组卷
|
4卷引用:河南等省五岳2020届高三4月联考(全国I卷)理综化学试题
河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题江西省九江市十校2020届高三下学期模拟考试理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
5 . 亚铁氰化钾{ }又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为
}又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为 ,回答问题:
,回答问题:
(1)写出基态 的核外电子排布式:
的核外电子排布式:___________ 。
(2) 中的作用力除共价键外,还有
中的作用力除共价键外,还有___________ 和___________ 。含有12molσ键的 的物质的量为1mol。
的物质的量为1mol。
(3)黄血盐中C原子的杂化方式为sp;C、N、O的第一电离能由大到小的排序为___________ ,电负性由大到小的排序为___________ 。
(4)Fe、Na、K的晶体结构如图所示:
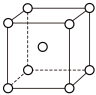
①钠的熔点比钾更高,原因是___________ 。
②Fe原子半径是rcm,阿伏加德罗常数为 ,铁的相对原子质量为a,则铁单质的密度是
,铁的相对原子质量为a,则铁单质的密度是___________  。
。
 }又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为
}又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为 ,回答问题:
,回答问题:(1)写出基态
 的核外电子排布式:
的核外电子排布式:(2)
 中的作用力除共价键外,还有
中的作用力除共价键外,还有 的物质的量为1mol。
的物质的量为1mol。(3)黄血盐中C原子的杂化方式为sp;C、N、O的第一电离能由大到小的排序为
(4)Fe、Na、K的晶体结构如图所示:

①钠的熔点比钾更高,原因是
②Fe原子半径是rcm,阿伏加德罗常数为
 ,铁的相对原子质量为a,则铁单质的密度是
,铁的相对原子质量为a,则铁单质的密度是 。
。
您最近一年使用:0次
名校
6 . 下列与分子性质有关的说法正确的是
| A.氟代丙二酸(HOOC—CF2—COOH)的酸性强于丙二酸(HOOC—CH2—COOH)是因为—CF2—的极性大于—CH2—的极性,导致氟代丙二酸羧基中—OH的极性更大更易电离出H+ |
B.邻硝基苯酚(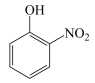 )的沸点高于对硝基苯酚( )的沸点高于对硝基苯酚(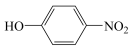 )是因为后者形成了分子间氢键 )是因为后者形成了分子间氢键 |
| C.C的电负性强于Si,所以CH4的熔沸点高于SiH4 |
| D.I2受热易升华,是因为分子内共价键键能较小所致 |
您最近一年使用:0次
名校
7 . 下列说法错误的是
| A.中心原子是 sp 杂化的,其分子的空间结构一定为直线形 |
| B.氢键(X-H…Y)中三原子在一条直线上时,作用力最强 |
| C.共价化合物中,电负性大的成键元素表现为负价 |
| D.σ 键可以绕键轴旋转,π 键一定不能绕键轴旋转 |
您最近一年使用:0次
2022-04-29更新
|
174次组卷
|
3卷引用:广东省广州市育才中学2021-2022学年高二下学期期中考试化学试题
8 . 下列叙述及相关解释均正确的是
| 选项 | 叙述 | 解释 |
| A | 还原性:HI>HBr | 范德华力:HI>HCl |
| B | 稳定性: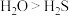 | O与S同主族,得电子能力:O<S |
| C | 沸点: | 前者能形成分子内氢键后者能形成分子间氢键 |
| D | 键的极性的强弱:H-O<H-F | 电负性:O<F |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O2 2
2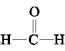 +2H2O
+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为_______ 。
(2)H2O的中心原子上的孤电子对数为_______ 。
(3)HCHO分子内σ键与π键个数之比为_______ ,HCHO的空间结构为_______ 。
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为_______ 和_______ 。
(5)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:_______ 。
 2
2 +2H2O
+2H2O(1)C、H、O 三种元素的电负性由大到小的顺序为
(2)H2O的中心原子上的孤电子对数为
(3)HCHO分子内σ键与π键个数之比为
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为
(5)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:
您最近一年使用:0次
10 . 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Z的最外层电子数等于W的核外电子数。下列叙述正确的是
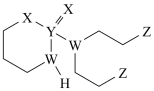

| A.W位于第二周期IIIA族 |
| B.基态Y原子只有1个未成对电子 |
| C.W、Z的最简单氢化物混合物的沸点,前者小于后者 |
| D.电负性:W>Y |
您最近一年使用:0次
2022-06-03更新
|
190次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2022届高三考前测试化学试题



