名校
解题方法
1 . 下图分别表示,冰晶体结构、干冰晶胞、金刚石晶体结构,关于这些晶体的说法,正确的是


| A.冰晶体中只存在分子间作用力 |
| B.沸点:金刚石>干冰>冰 |
| C.冰晶体中的O原子和金刚石中的C原子都是sp3杂化 |
| D.干冰晶体中每个CO2周围等距离且最近的CO2有4个 |
您最近一年使用:0次
2022-04-16更新
|
187次组卷
|
2卷引用:湖南省娄底市双峰县第一中学2021-2022学年高二下学期四月月考化学试题
名校
解题方法
2 . 冠醚能与阳离子尤其是与碱金属离子作用,并随环的大小不同而与不同碱金属离子作用,12—冠—4与锂离子作用而不与钠离子、钾离子作用,18—冠—6与钾离子作用如图,但不与锂离子或钠离子作用,下列说法不正确的是
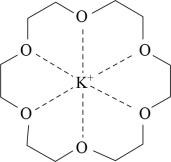
| A.18—冠—6中C原子和O原子的杂化轨道类型相同 |
| B.与K+作用不与Li+和Na+作用反应反映了超分子的“分子识别”的特征 |
| C.与钾离子作用反映了超分子的“自组装”的特征 |
| D.冠醚与碱金属离子作用的原理与其可做相转移催化剂的原理有关 |
您最近一年使用:0次
2022-04-16更新
|
478次组卷
|
8卷引用:湖南省娄底市双峰县第一中学2021-2022学年高二下学期四月月考化学试题
名校
解题方法
3 . 我国科学家制备的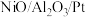 催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:
催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理: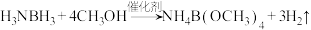
请回答下列问题:
(1)基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为_______ 。
(2)已知几种元素的电负性如下表所示。
①上述制氢反应中,有_______ 种元素的原子采取 杂化。
杂化。
② 中键角∠HNH
中键角∠HNH_______ (填“大于”、“小于”或“等于”)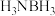 中键角∠HNH。
中键角∠HNH。
③B、C、N、O的电负性依次增大,其主要原因是_______ 。
④在氨硼烷中,H—B键中H带部分_______ (填“正”或“负”)电荷。
(3)某有机硼化合物的结构简式如图1所示,1mol该有机物中含_______ mol 键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
键。组成该有机物的第二周期元素第一电离能由大到小的顺序为_______ (填元素符号)。

(4)磷化硼是一种新型无机非金属材料,晶胞结构如图2所示。以晶胞参数为单位长度建立坐标系,表示晶胞中各原子的位置,称为原子坐标。a点磷原子的坐标为(0,0,0),b点磷原子的坐标为(1,1,0),则c点硼原子的坐标为_______ 。

(5)四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图3所示。

① 的空间构型为
的空间构型为_______ , 的配位数为
的配位数为_______ 。
②已知NA为阿伏加德罗常数的值,晶体的密度为_______ (用含a、NA的代数式表示) 。
。
 催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:
催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理: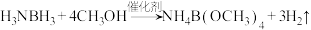
请回答下列问题:
(1)基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为
(2)已知几种元素的电负性如下表所示。
| 元素 | H | B | C | N | O |
| 电负性 | 2.1 | 2.0 | 2.5 | 3.0 | 3.5 |
 杂化。
杂化。②
 中键角∠HNH
中键角∠HNH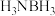 中键角∠HNH。
中键角∠HNH。③B、C、N、O的电负性依次增大,其主要原因是
④在氨硼烷中,H—B键中H带部分
(3)某有机硼化合物的结构简式如图1所示,1mol该有机物中含
 键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
(4)磷化硼是一种新型无机非金属材料,晶胞结构如图2所示。以晶胞参数为单位长度建立坐标系,表示晶胞中各原子的位置,称为原子坐标。a点磷原子的坐标为(0,0,0),b点磷原子的坐标为(1,1,0),则c点硼原子的坐标为

(5)四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图3所示。

①
 的空间构型为
的空间构型为 的配位数为
的配位数为②已知NA为阿伏加德罗常数的值,晶体的密度为
 。
。
您最近一年使用:0次
2022-04-15更新
|
803次组卷
|
11卷引用:湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题
湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题湖南省常德市澧县第一中学2021-2022学年高三下学期期中考试化学试题湖南省绥宁县第一中学2022-2023学年高二下学期期中考试化学试题陕西省榆林市 2022届高三第三次模拟考试化学试题(已下线)【直抵名校】02-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点48 晶体结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
4 . 短周期元素W、X、Y、Z在周期表中的相对位置如图所示。Y的核电荷数是X的两倍,下列说法正确的是
| W | X | |
| Y | Z |
| A.非金属性:Z>Y>X |
B.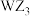 与氨分子具有不同的空间构型 与氨分子具有不同的空间构型 |
| C.X分别与W、Y、Z均可形成两种或两种以上的二元化合物 |
D.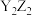 结构稳定,不易发生歧化反应 结构稳定,不易发生歧化反应 |
您最近一年使用:0次
2022-04-14更新
|
197次组卷
|
2卷引用:湖南省衡阳市衡东县第一中学2022届高三下学期期中考试化学试题
名校
解题方法
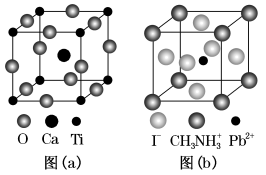
5 . 钙钛矿型化合物是一类可用于生产太阳能电池、传感器等的功能材料,其一种晶胞如图(a)所示,一种具有立方钙钛矿结构的金属卤化物光电材料的组成为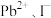 和有机碱离子
和有机碱离子 其晶胞如图(b)所示,下列说法错误的是
其晶胞如图(b)所示,下列说法错误的是
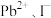 和有机碱离子
和有机碱离子 其晶胞如图(b)所示,下列说法错误的是
其晶胞如图(b)所示,下列说法错误的是 
A.基态 的核外电子排布式为 的核外电子排布式为 |
B.图(a)对应钙钛矿型化合物的化学式为 |
C.图(b)中 与图(a)中 与图(a)中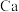 的空间位置相同 的空间位置相同 |
D.图(a)对应化合物中与 等距离且最近的 等距离且最近的 有6个 有6个 |
您最近一年使用:0次
2022-04-13更新
|
997次组卷
|
7卷引用:湖南省长沙市明德中学2023届高三上学期入学检测化学试题
湖南省长沙市明德中学2023届高三上学期入学检测化学试题辽宁省沈阳市郊联体2022届高三下学期4月份线上考试化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)三轮冲刺卷2-【赢在高考黄金20卷】备战2022年高考化学模拟卷(辽宁专用)进阶训练4广东省汕头市金山中学2023届高三下学期一模化学试题(已下线)专题06 物质结构与性质
名校
6 . A、B、C、D短周期的四种元素,原子序数依次增大。A、B、D三种元素分别位于不同短周期的不同主族。C、D对应的简单离子核外电子排布相同,A、B、C、D元素可形成一种新型漂白剂(结构如图),下列说法正确的是


| A.电负性C>B>A>D | B.B、C杂化方式不同 |
| C.该化合物1mol阴离子含有1mol配位键 | D.漂白剂中C的化合价-1、-2价 |
您最近一年使用:0次
2022-04-12更新
|
679次组卷
|
4卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二下学期期中考试化学试题
名校
7 . 甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应为HCHO+O2 H2O+CO2。下列有关叙述正确的是
H2O+CO2。下列有关叙述正确的是
 H2O+CO2。下列有关叙述正确的是
H2O+CO2。下列有关叙述正确的是| A.HCHO分子中σ键和π键的数目之比为2∶1 | B.16O原子中的中子数为16 |
| C.CO2的空间构型为直线形 | D.H2O与D2O互为同素异形体 |
您最近一年使用:0次
2022-04-11更新
|
40次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期5月期中考试化学试题
名校
解题方法
8 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
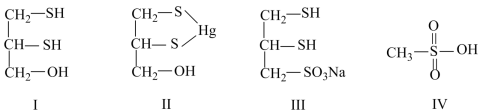
(1)H2S、CH4、H2O 沸点由高到低顺序为
沸点由高到低顺序为_______ 。
(2)汞的原子序数为80,位于元素周期表中的位置是_______ 。
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV_______ 硫酸(填“>”或“<”)
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有_______ 。
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是_______ 。(填“化合物I”或“化合物Ⅲ”)

(1)H2S、CH4、H2O
 沸点由高到低顺序为
沸点由高到低顺序为(2)汞的原子序数为80,位于元素周期表中的位置是
(3)化合物Ⅳ是一种强酸,请基于理论比较IV和硫酸的pKa1:化合物IV
(4)化合物Ⅲ也是一种汞解毒剂。下列关于上述物质的说法正确的有
A.在I和Ⅲ中S原子均采取sp3杂化
B.在Ⅱ中所有元素中S元素的电负性最大
C.在Ⅲ中C—C—C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的物质是
您最近一年使用:0次
名校
解题方法
9 . 含镓(Ga)化合物在半导体材料、医药行业等领域发挥重要作用。回答下列问题:
(1)基态镓原子最外层的电子排布图为___________ 。
(2)Ga与Zn的第一电离能大小关系为:Ga___________ Zn(填“>”“<”或“=”)。
(3)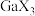 的熔沸点如下表所示。
的熔沸点如下表所示。
①100℃, 、
、 和
和 呈液态的是
呈液态的是___________ (填化学式),沸点依次升高的原因是___________ 。
② 的熔点约1000℃,远高于
的熔点约1000℃,远高于 的熔点,原因是
的熔点,原因是___________ 。
(4)镓配合物具有高的反应活性和良好的选择性。在药物领域得到广泛的关注。 与2-甲基8-羟基喹啉(
与2-甲基8-羟基喹啉( )在一定条件下反应可以得到一种喹啉类镓配合物(M),其结构如图所示。2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为
)在一定条件下反应可以得到一种喹啉类镓配合物(M),其结构如图所示。2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为___________ ;H、C、N的原子半径由大到小的顺序为___________ 。

(5)作为第二代半导体,砷化镓单晶因其价格昂贵而素有“半导体贵族”之称。砷化镓是由 和
和 在一定条件下制备得到,同时得到另一物质,该物质分子是
在一定条件下制备得到,同时得到另一物质,该物质分子是___________ (填“极性分子”或“非极性分子”),  分子的空间形状为
分子的空间形状为___________ 。
(6)GaN是制造LED的重要材料,被誉为“第三代半导体材料”。其晶体结构如图所示:

①在GaN晶体中,距离每个Ga原子最近的Ga原子有___________ 个,N原子的配位数为___________ 。
②GaN的密度为___________  。(设阿伏加德罗常数的值为
。(设阿伏加德罗常数的值为 ,用含a、c、
,用含a、c、 的代数式表示)
的代数式表示)
(1)基态镓原子最外层的电子排布图为
(2)Ga与Zn的第一电离能大小关系为:Ga
(3)
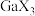 的熔沸点如下表所示。
的熔沸点如下表所示。| 镓的卤化物 |  |  |  |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
 、
、 和
和 呈液态的是
呈液态的是②
 的熔点约1000℃,远高于
的熔点约1000℃,远高于 的熔点,原因是
的熔点,原因是(4)镓配合物具有高的反应活性和良好的选择性。在药物领域得到广泛的关注。
 与2-甲基8-羟基喹啉(
与2-甲基8-羟基喹啉( )在一定条件下反应可以得到一种喹啉类镓配合物(M),其结构如图所示。2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为
)在一定条件下反应可以得到一种喹啉类镓配合物(M),其结构如图所示。2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为
(5)作为第二代半导体,砷化镓单晶因其价格昂贵而素有“半导体贵族”之称。砷化镓是由
 和
和 在一定条件下制备得到,同时得到另一物质,该物质分子是
在一定条件下制备得到,同时得到另一物质,该物质分子是 分子的空间形状为
分子的空间形状为(6)GaN是制造LED的重要材料,被誉为“第三代半导体材料”。其晶体结构如图所示:

①在GaN晶体中,距离每个Ga原子最近的Ga原子有
②GaN的密度为
 。(设阿伏加德罗常数的值为
。(设阿伏加德罗常数的值为 ,用含a、c、
,用含a、c、 的代数式表示)
的代数式表示)
您最近一年使用:0次
2022-04-11更新
|
403次组卷
|
4卷引用:湖南省新高考教学教研联盟2021-2022学年高三下学期第二次联考化学试题
湖南省新高考教学教研联盟2021-2022学年高三下学期第二次联考化学试题湖南省怀化市洪江市第一中学2021-2022学年高三下学期第二次月考模拟化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 碳、硅及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Si原子价层电子的运动状态有_______ 种。
(2)C、O、Si电负性由小到大的顺序为_______ ;CS2分子的空间构型为_______ ;CS2的熔点_______ (填“高于”或“低于”)CO2。
(3)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:

部分化学键的键能如表所示:
SiO2晶体中Si原子采取的构型是_______ (填“甲”或“乙”),其杂化方式为_______ ,从能量角度解释Si原子采取该构型的原因是_______ 。
(4)碳化硅(SiC)是人工合成的无机非会属材料,其晶体结构类似于金刚石,结构如图所示:

①在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是_______ (填字母)。
a. b.
b.  c.
c.  d.
d. 
②SiC晶体中硅原子与最近碳原子间距离为d cm,则硅原子与最近的硅原子间距离为_______ ,一个硅原子周围与其最近的硅原子的数目为_______ 。
③如果SiC晶胞边长为a nm,则SiC晶体的密度为_______ g·cm-3。(用含有a的式子表示)
(1)基态Si原子价层电子的运动状态有
(2)C、O、Si电负性由小到大的顺序为
(3)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:

部分化学键的键能如表所示:
| 化学键 | 键能/(kJ·mol-1) | 化学键 | 键能/(kJ·mol-1) |
| C-C | 331 | C-O | 343 |
| Si-Si | 197 | Si-O | 466 |
| C=C | 620 | CO | 805 |
| Si-Si | 272 | Si=O | 640 |
(4)碳化硅(SiC)是人工合成的无机非会属材料,其晶体结构类似于金刚石,结构如图所示:

①在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是
a.
 b.
b.  c.
c.  d.
d. 
②SiC晶体中硅原子与最近碳原子间距离为d cm,则硅原子与最近的硅原子间距离为
③如果SiC晶胞边长为a nm,则SiC晶体的密度为
您最近一年使用:0次
2022-04-11更新
|
202次组卷
|
2卷引用:湖南省岳阳市岳阳县2021-2022学年高三下学期适应性考试化学试题



