解题方法
1 . 氯化铵焙烧菱锰矿 (主要成分为  , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
②常温下, 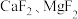 的溶度积分别为
的溶度积分别为 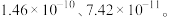
回答下列问题:
(1)基态锰原子的电子排布式为______ ,  的空间结构为
的空间结构为_______ 。
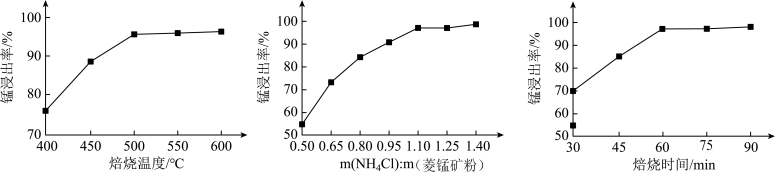
(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是_______ 。
(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的_______ (填化学式)。
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为_______ ; 若溶液中金属离子浓度均为0.1 mol·L-1,调节溶液pH使 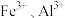 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为_______ ,再加入NH4F 沉淀Ca²⁺、Mg²⁺,_______ ,当 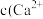 +
+  时,
时,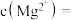
_______ 
(5)碳化结晶时,发生反应的离子方程式为_______ 。
(6)流程中能循环利用的固态物质是_______ (填化学式)。
 , 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下:
, 含少量Fe、Al、Ca、Mg等元素)制备高纯度碳酸锰的工艺流程如下: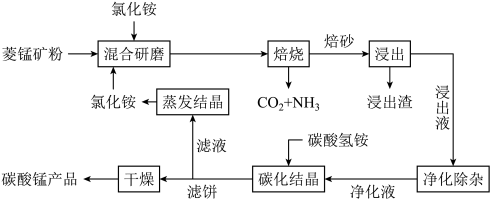
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的 pH | 3.8 | 1.5 | 6.5 | 10.6 | 8.1 | 9.6 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 12.6 | 10.1 | 11.6 |
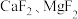 的溶度积分别为
的溶度积分别为 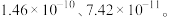
回答下列问题:
(1)基态锰原子的电子排布式为
 的空间结构为
的空间结构为(2)由下图可知, 氯化铵焙烧菱锰矿的最佳条件: m(NH4Cl):m(菱锰矿粉)=1.10:1, 500℃焙烧60min,不选用600℃焙烧 90min的原因是

(3)焙烧产生的CO2和NH3可用于工业制备纯碱,操作时应先向饱和食盐水中通入过量的
(4)浸出液“净化除杂”过程如下:首先加入 MnO2将 Fe2+氧化为Fe3+,反应的离子方程式为
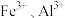 沉淀完全,此时溶液的pH 范围为
沉淀完全,此时溶液的pH 范围为 +
+  时,
时,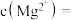
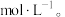
(5)碳化结晶时,发生反应的离子方程式为
(6)流程中能循环利用的固态物质是
您最近一年使用:0次
解题方法
2 . 羟胺(NH2OH)是一种重要的化工原料,羟胺水溶液呈碱性的原理与氨水类似,氮原子上电 子 云 密 度 越 大 碱 性 越 强 。 可 以 利 用 羟 胺 制 备 硫 酸 羟 胺 : 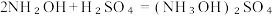 ,下列说法不正确的是
,下列说法不正确的是
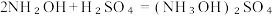 ,下列说法不正确的是
,下列说法不正确的是| A.(NH3OH)2SO4中N、S原子均为sp3杂化 | B.H-N-H键角: 羟胺>NH |
| C.同浓度水溶液的碱性:NH3>羟胺 | D.1molNH2OH中含有4molσ键 |
您最近一年使用:0次
名校
3 . 下图所示装置不能达到目的的是
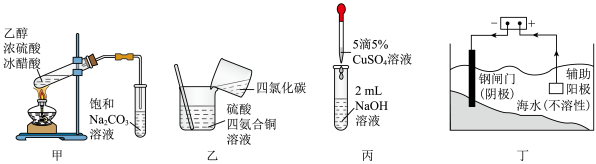
| A.用图甲装置制备乙酸乙酯 |
| B.用图乙装置制备硫酸四氨合铜晶体 |
C.用图丙装置制备检验醛基用的 |
| D.用图丁装置保护钢铁设备 |
您最近一年使用:0次
名校
4 . 下列说法正确的是
A. 分子中,C—Cl键采用的成键轨道是 分子中,C—Cl键采用的成键轨道是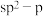 |
B.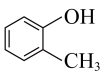 和 和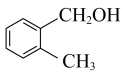 互为同系物 互为同系物 |
| C.单晶硅和石英互为同素异形体 |
D. 的电子云图为 的电子云图为 ,其中的黑点代表核外电子的运动轨迹 ,其中的黑点代表核外电子的运动轨迹 |
您最近一年使用:0次
名校
5 . 一种2-甲基色酮内酯(Y)可通过下列反应合成,下列说法正确的是
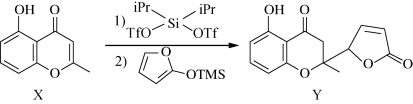
| A.X分子中碳原子的杂化类型都相同 | B.Y分子中所有碳原子均可能处于同平面 |
| C.X、Y均可发生消去反应 | D.1molY与NaOH反应最多消耗2molNaOH |
您最近一年使用:0次
2024-05-26更新
|
172次组卷
|
2卷引用:重庆市名校联盟2023-2024学年高三下学期全真模拟考试化学试题
名校
6 . 下列说法错误的是
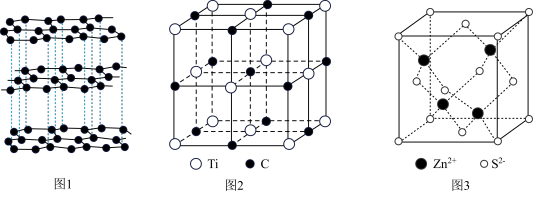
| A.图1晶体中既存在共价键又存在范德华力,属于混合型晶体 |
| B.图2为某气态团簇分子的结构,该气态团簇分子的化学式为TiC |
C.图3为ZnS的晶胞结构, 的配位数为4 的配位数为4 |
D.图3为ZnS的晶胞结构,已知该晶体的密度为 , , 为阿伏加德罗常数的值,则晶胞中 为阿伏加德罗常数的值,则晶胞中 和 和 的最近距离为 的最近距离为 |
您最近一年使用:0次
2024-05-26更新
|
131次组卷
|
2卷引用:重庆市名校联盟2023-2024学年高三下学期全真模拟考试化学试题
名校
7 . 硫酸亚铁铵[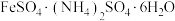 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为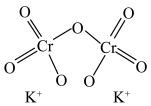 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
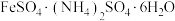 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。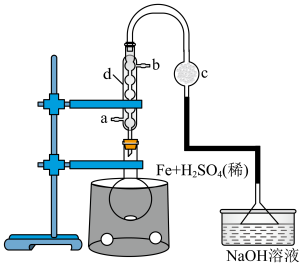
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C.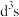 | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
122次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
8 . 化合物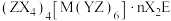 含有4种主族元素,只有M为金属,在地壳中的含量仅次于铝,Y、Z、E同周期。Z的基态原子价层p轨道为半充满状态,X的基态原子价层电子排布式为
含有4种主族元素,只有M为金属,在地壳中的含量仅次于铝,Y、Z、E同周期。Z的基态原子价层p轨道为半充满状态,X的基态原子价层电子排布式为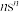 ,E的基态原子p轨道电子数与Y的价层电子数相同。下列说法正确的是
,E的基态原子p轨道电子数与Y的价层电子数相同。下列说法正确的是
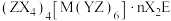 含有4种主族元素,只有M为金属,在地壳中的含量仅次于铝,Y、Z、E同周期。Z的基态原子价层p轨道为半充满状态,X的基态原子价层电子排布式为
含有4种主族元素,只有M为金属,在地壳中的含量仅次于铝,Y、Z、E同周期。Z的基态原子价层p轨道为半充满状态,X的基态原子价层电子排布式为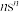 ,E的基态原子p轨道电子数与Y的价层电子数相同。下列说法正确的是
,E的基态原子p轨道电子数与Y的价层电子数相同。下列说法正确的是A.Y、Z、E与X形成的化合物的沸点: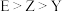 |
B.该化合物的溶液可以与 形成蓝色沉淀 形成蓝色沉淀 |
| C.Y、Z、E元素的第二电离能最大的是E |
D.阴离子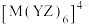 中M的配位数为4 中M的配位数为4 |
您最近一年使用:0次
2024-05-26更新
|
165次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
名校
9 . 体育锻炼时,大脑会产生5-羟色氨酸(结构如图所示),有益于防止焦虑、抑郁。下列说法正确的是
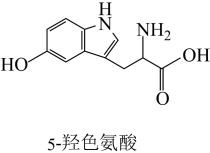
A.分子式为 |
| B.光照下与氯气反应,苯环上可以形成C—Cl键 |
| C.与足量碳酸氢钠溶液反应,所有的O—H键均可断裂 |
| D.环上的碳原子、氮原子的杂化类型相同 |
您最近一年使用:0次
名校
10 . 如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是
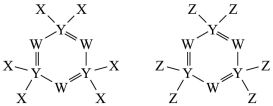
| A.电负性:X>Y>Z |
| B.HZO为弱酸,分子的空间结构为直线型 |
| C.最高价含氧酸酸性:W<Y |
| D.X、W和氢三种元素可形成含阴阳离子都为10电子的化合物 |
您最近一年使用:0次



