1 .  和
和 均属于稀有金属,在生产、科技和军事领域均有重要的研究和应用价值。回答下列问题:
均属于稀有金属,在生产、科技和军事领域均有重要的研究和应用价值。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ ;基态 原子占据最高能层的核外电子的电子云轮廓图的形状为
原子占据最高能层的核外电子的电子云轮廓图的形状为_______ 。
(2) 和
和 处于同一周期,且核外最高能层电子构型相同。金属
处于同一周期,且核外最高能层电子构型相同。金属 的熔点
的熔点_______ (填“高于”或“低于”)金属 ,原因为
,原因为_______ 。
(3) 能形成多种重要配合物,如
能形成多种重要配合物,如 能形成
能形成 能形成
能形成 、
、 等。
等。
 ①中所含阴离子的每个原子最外层均满足
①中所含阴离子的每个原子最外层均满足 结构。该阴离子的立体构型为
结构。该阴离子的立体构型为_______ ,其中心原子的杂化形式为_______ 。
② 中含有
中含有 键的数目为
键的数目为_______ 。
(4) 能形成多种化合物,如
能形成多种化合物,如 、
、 。基态
。基态 原子的第一电离能
原子的第一电离能_______  填“大于”或“小于”
填“大于”或“小于” 基态
基态 原子。
原子。
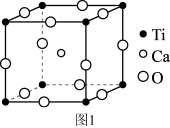
(5)钛酸钙晶胞结构如图1所示。钛酸钙的化学式为_______ ; 个钛离子与
个钛离子与_______ 个氧离子等距离且最近,连接这些氧离子构成正八面体,钛离子位于该正八面体的体心。
(6)铁和氮可组成一种过渡金属氮化物,其晶胞结构如图2所示。六棱柱底边边长为 ,高为
,高为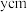 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则它的密度为
,则它的密度为_______  (列算式即可) 。
(列算式即可) 。
 和
和 均属于稀有金属,在生产、科技和军事领域均有重要的研究和应用价值。回答下列问题:
均属于稀有金属,在生产、科技和军事领域均有重要的研究和应用价值。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为 原子占据最高能层的核外电子的电子云轮廓图的形状为
原子占据最高能层的核外电子的电子云轮廓图的形状为(2)
 和
和 处于同一周期,且核外最高能层电子构型相同。金属
处于同一周期,且核外最高能层电子构型相同。金属 的熔点
的熔点 ,原因为
,原因为(3)
 能形成多种重要配合物,如
能形成多种重要配合物,如 能形成
能形成 能形成
能形成 、
、 等。
等。 ①中所含阴离子的每个原子最外层均满足
①中所含阴离子的每个原子最外层均满足 结构。该阴离子的立体构型为
结构。该阴离子的立体构型为②
 中含有
中含有 键的数目为
键的数目为(4)
 能形成多种化合物,如
能形成多种化合物,如 、
、 。基态
。基态 原子的第一电离能
原子的第一电离能 填“大于”或“小于”
填“大于”或“小于” 基态
基态 原子。
原子。(5)钛酸钙晶胞结构如图1所示。钛酸钙的化学式为
 个钛离子与
个钛离子与
(6)铁和氮可组成一种过渡金属氮化物,其晶胞结构如图2所示。六棱柱底边边长为
 ,高为
,高为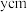 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则它的密度为
,则它的密度为 (列算式即可) 。
(列算式即可) 。
您最近一年使用:0次
名校
2 . 铬铁合金作为钢的添加料生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷等元素。
(1)基态Fe原子的价电子排布式为_______ 。
(2)第二周期中第一电离能介于B与N之间的元素有_______ 种。
(3)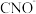 的空间构型为
的空间构型为_______ ,C的杂化方式为_______ 。
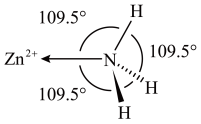
(4) 分子在独立存在时
分子在独立存在时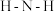 键角为
键角为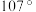 。如图是
。如图是 离子的部分结构以及
离子的部分结构以及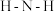 键角的测量值。解释
键角的测量值。解释 形成如图配合物后
形成如图配合物后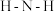 键角变大的原因:
键角变大的原因:_______ 。
(5)有机铁肥 中不存在的化学键有
中不存在的化学键有_______ 。(填字母)
A.离子键 B.金属键 C.配位键 D. 键 E.氢键
键 E.氢键
(6)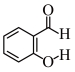 和
和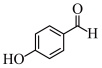 两种物质中,沸点更高的是
两种物质中,沸点更高的是 _______ (填名称)
(7)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色,该反应中有时用Fe(SCN)3表示形成的配合物,经研究表明Fe3+与SCN-不仅能以1:3的个数比配合,还可以以其他个数比配合。
请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供_______ ,SCN-提供_______ ,二者通过配位键结合。
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合,所得离子显红色,含该离子的配合物化学式是_______ 。
(1)基态Fe原子的价电子排布式为
(2)第二周期中第一电离能介于B与N之间的元素有
(3)
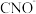 的空间构型为
的空间构型为(4)
 分子在独立存在时
分子在独立存在时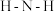 键角为
键角为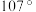 。如图是
。如图是 离子的部分结构以及
离子的部分结构以及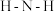 键角的测量值。解释
键角的测量值。解释 形成如图配合物后
形成如图配合物后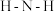 键角变大的原因:
键角变大的原因:
(5)有机铁肥
 中不存在的化学键有
中不存在的化学键有A.离子键 B.金属键 C.配位键 D.
 键 E.氢键
键 E.氢键(6)
 和
和 两种物质中,沸点更高的是
两种物质中,沸点更高的是 (7)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色,该反应中有时用Fe(SCN)3表示形成的配合物,经研究表明Fe3+与SCN-不仅能以1:3的个数比配合,还可以以其他个数比配合。
请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合,所得离子显红色,含该离子的配合物化学式是
您最近一年使用:0次
名校
解题方法
3 . Ⅰ. 有下列物质:①
有下列物质:① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦SiO2、⑧PCl3
、⑦SiO2、⑧PCl3
(1)常温下为共价晶体是_______ (填序号,下同)。
(2)既有 键又有
键又有 键的非极性分子是
键的非极性分子是_______ 。
(3) 模型是四面体形的极性分子是
模型是四面体形的极性分子是_______ 。
(4)分子空间构型三角锥形的是_______ 。
(5)中心原子发生 杂化的是
杂化的是_______ ,与甲烷分子空间结构相同的是_______ 。
Ⅱ.回答下列问题
(6) 中碳原子的杂化方式为
中碳原子的杂化方式为_______ 。 分子中
分子中 原子的杂化方式为
原子的杂化方式为_______ 。
(7)从结构角度分析, 的空间构型为
的空间构型为_______ 。 和
和 两种阳离子的相同之处为
两种阳离子的相同之处为_______ (填字母)。
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数 C.立体构型 D.共价键类型
(8)X射线衍射测定发现,I3AsF6中存在I 。I
。I 的立体构型为
的立体构型为_______ ,中心原子的杂化方式为_______ 。
 有下列物质:①
有下列物质:① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦SiO2、⑧PCl3
、⑦SiO2、⑧PCl3(1)常温下为共价晶体是
(2)既有
 键又有
键又有 键的非极性分子是
键的非极性分子是(3)
 模型是四面体形的极性分子是
模型是四面体形的极性分子是(4)分子空间构型三角锥形的是
(5)中心原子发生
 杂化的是
杂化的是Ⅱ.回答下列问题
(6)
 中碳原子的杂化方式为
中碳原子的杂化方式为 分子中
分子中 原子的杂化方式为
原子的杂化方式为(7)从结构角度分析,
 的空间构型为
的空间构型为 和
和 两种阳离子的相同之处为
两种阳离子的相同之处为A.中心原子的杂化轨道类型 B.中心原子的价层电子对数 C.立体构型 D.共价键类型
(8)X射线衍射测定发现,I3AsF6中存在I
 。I
。I 的立体构型为
的立体构型为
您最近一年使用:0次
2016高二·全国·课时练习
名校
4 . 已知某紫色配合物的组成为CoCl3·5NH3·H2O,其水溶液显弱酸性,加入强碱并加热至沸腾有NH3放出,同时产生Co2O3沉淀;向一定量该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,待沉淀完全后过滤,再加过量AgNO3溶液于滤液中,无明显变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一,则该配合物的化学式最可能为
| A.[CoCl2(NH3)4]Cl·NH3·H2O | B.[Co(NH3)5(H2O)]Cl3 |
| C.[CoCl2(NH3)3(H2O)]Cl·2NH3 | D.[CoCl(NH3)5]Cl2·H2O |
您最近一年使用:0次
2022-08-20更新
|
402次组卷
|
6卷引用:重庆市清华中学2021-2022学年高二下学期期第一次月考化学试题
重庆市清华中学2021-2022学年高二下学期期第一次月考化学试题(已下线)同步君 选修3 第二章 第二节 配合物理论高中化学人教版 选修三 第2章 分子结构与性质 配合物理论(已下线)微项目 补铁剂中铁元素的检验-应用配合物进行物质检验-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)吉林省通化市梅河口市第五中学2022-2023学年高二上学期期末考试化学试题(已下线)3.4 配合物与超分子-同步学习必备知识
名校
解题方法
5 . 下列描述中,正确的是
| A.CS2是空间结构为V形的极性分子 |
B.ClO 和ClO 和ClO 的VSEPR模型相同,但离子空间结构不同 的VSEPR模型相同,但离子空间结构不同 |
C.NO 和NH3的空间结构均为三角锥形 和NH3的空间结构均为三角锥形 |
D.SiF4和CO 的中心原子的杂化轨道类型均为sp3杂化 的中心原子的杂化轨道类型均为sp3杂化 |
您最近一年使用:0次
名校
解题方法
6 . 第24届冬奥会于2022年2月4日在北京隆重开幕,“科技冬奥”理念,体现在方方面面。回答下列有关问题:
(1)冬奥会采用的石墨烯(即单层石墨)材料制造户外保暖穿戴设备,该材料中的碳原子采取_______ 杂化,属于元素周期表中_______ 区,同主族的元素基态Ge原子核外电子的空间运动状态有_______ 种。
奥运会场馆使用了大量的合金。第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。
(2)基态Fe2+与Fe3+离子的最外层电子数之比为_______ ,实验室常用A离子来检验Fe3+离子,且又是CO2的某一种等电子体,写出A离子的结构式_______ 。
(3)Fe(CO)5是一种黄色粘稠状液体化合物,则CO作配体时,配位原子是_______ ,其原因是_______ 。
(4)写出与Ni同周期元素中,基态原子未成对电子数与Ni相同的元素名称_______ 。
(5)如表为Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是_______ (填“4”或“6”)
(6)目前新能源汽车电池主要是磷酸铁锂(LiFePO4)和三元锂电池(正极含有Ni、Co、Mn三种元素)。LiFePO4中阴离子的立体构型名称是_______ 。三元锂电池的负极材料是石墨,石墨晶体的二维平面结构如图1所示,晶胞结构如图2所示。根据图2计算石墨晶体的密度是_______ g/cm3(写出表达式即可)。
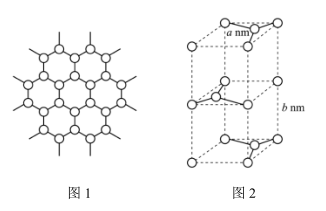
(1)冬奥会采用的石墨烯(即单层石墨)材料制造户外保暖穿戴设备,该材料中的碳原子采取
奥运会场馆使用了大量的合金。第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。
(2)基态Fe2+与Fe3+离子的最外层电子数之比为
(3)Fe(CO)5是一种黄色粘稠状液体化合物,则CO作配体时,配位原子是
(4)写出与Ni同周期元素中,基态原子未成对电子数与Ni相同的元素名称
(5)如表为Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是
| 离子 | 配位数 | 晶体场稳定化能(Dq) | 离子 | 配位数 | 晶体场稳定化能(Dq) |
| Co2+ | 6 | -8Dq+2p | Ni2+ | 6 | -12Dq+3p |
| 4 | -5.34Dq+2p | 4 | -3.56Dq+3p |
(6)目前新能源汽车电池主要是磷酸铁锂(LiFePO4)和三元锂电池(正极含有Ni、Co、Mn三种元素)。LiFePO4中阴离子的立体构型名称是

您最近一年使用:0次
名校
解题方法
7 . 碳元素可以形成多种物质,回答下列问题:
(1)基态C原子的价层电子排布式为_______ 。
(2)CO2的空间构型是_______ , 下列与CO2具有相同类型化学键和立体构型的是______ (填序号)。
a.OCN- b.SO2 c. d.
d.
(3)石墨具有平面层状结构(如图甲),则石墨的晶体类型是_______ ;石墨的晶胞结构如图乙,已知石墨的密度为ρ g·cm-3, C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体中的层间距d=_______ cm。
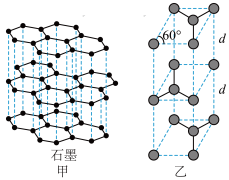
石墨与熔融态的Na单质相互作用,形成石墨间隙化合物(其中的元素Na用“●”表示),原子分布如图,则该物质的化学式为_______ 。

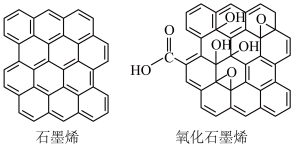
(4)下图是两种石墨材料局部结构示意图,其中石墨烯中碳原子紧密堆积成单层二维蜂窝状晶格结构。石墨烯具有良好的导电性,其中碳原子杂化轨道类型为_______ ,大π键表示为_______ (用n表示电子数),氧化石墨烯具有较好的亲水性的原因是_______ 。
(1)基态C原子的价层电子排布式为
(2)CO2的空间构型是
a.OCN- b.SO2 c.
 d.
d.
(3)石墨具有平面层状结构(如图甲),则石墨的晶体类型是

石墨与熔融态的Na单质相互作用,形成石墨间隙化合物(其中的元素Na用“●”表示),原子分布如图,则该物质的化学式为

(4)下图是两种石墨材料局部结构示意图,其中石墨烯中碳原子紧密堆积成单层二维蜂窝状晶格结构。石墨烯具有良好的导电性,其中碳原子杂化轨道类型为

您最近一年使用:0次
名校
解题方法
8 . 卤代烃在有机合成中发挥着重要桥梁作用,研究卤代烃的反应历程十分有意义。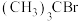 发生水解反应的历程如图所示:
发生水解反应的历程如图所示:
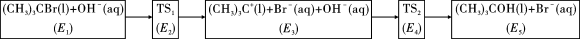
说明:①E表示方框中物质的总能量(单位:kJ/mol),TS表示过渡态。
②相关化学键键能: 为351kJ/mol。
为351kJ/mol。
下列说法错误的是
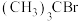 发生水解反应的历程如图所示:
发生水解反应的历程如图所示: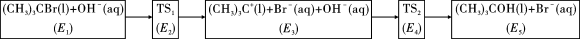
说明:①E表示方框中物质的总能量(单位:kJ/mol),TS表示过渡态。
②相关化学键键能:
 为351kJ/mol。
为351kJ/mol。下列说法错误的是
| A.水解反应过程中中心碳原子的杂化轨道类型发生变化 |
B.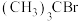 水解总反应的 水解总反应的 可表示为 可表示为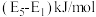 |
C.若 ,则决定速率步骤的化学方程式为 ,则决定速率步骤的化学方程式为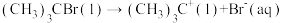 |
D.若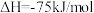 ,C—Br键能为426kJ/mol ,C—Br键能为426kJ/mol |
您最近一年使用:0次
名校
解题方法
9 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)[Cu(NH3)2]SO4溶液可以吸收合成氨中对催化剂有毒害的CO气体,反应的化学方程式为:[Cu(NH3)2]SO4+CO+NH3⇌[Cu(NH3)3CO]SO4
①基态Cu+的价层电子排布图为_______ 。
② 的空间结构为
的空间结构为_______ 。
③N、O和S的第一电离能由大到小的顺序是_______ (用元素符号表示)。
④[Cu(NH3)3CO]SO4晶体中存在的化学键类型有_______ (填字母)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键 E.配位键 F.π键
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
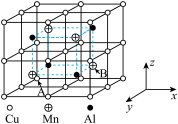
①该合金的化学式为_______ 。
②若A原子的坐标参数为(0,0,0),则B原子的坐标参数为_______ 。
③已知该合金晶体的密度为ρ g·cm-3,则最近的两个Cu原子间的距离为_______ nm(阿伏加德罗常数的值用NA表示)。
(1)[Cu(NH3)2]SO4溶液可以吸收合成氨中对催化剂有毒害的CO气体,反应的化学方程式为:[Cu(NH3)2]SO4+CO+NH3⇌[Cu(NH3)3CO]SO4
①基态Cu+的价层电子排布图为
②
 的空间结构为
的空间结构为③N、O和S的第一电离能由大到小的顺序是
④[Cu(NH3)3CO]SO4晶体中存在的化学键类型有
A.离子键 B.极性共价键 C.非极性共价键 D.氢键 E.配位键 F.π键
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①该合金的化学式为
②若A原子的坐标参数为(0,0,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρ g·cm-3,则最近的两个Cu原子间的距离为
您最近一年使用:0次
10 . 物质世界丰富多彩,物质结构千变万化。回答下列问题:
(1)已知 熔沸点较低,常温下呈液态,易溶于有机溶剂,则
熔沸点较低,常温下呈液态,易溶于有机溶剂,则 晶体为
晶体为_______ (填晶体类型), 中含有
中含有_______  键。
键。
(2)某配合物化学式为 ,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量
,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量 溶液,产生2mol白色沉淀,则其中Co的化合价为
溶液,产生2mol白色沉淀,则其中Co的化合价为_______ 价,将该配合物溶于水中形成的阳离子化学式为_______ 。
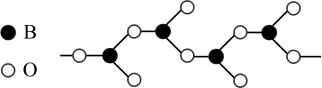
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为_______ 。
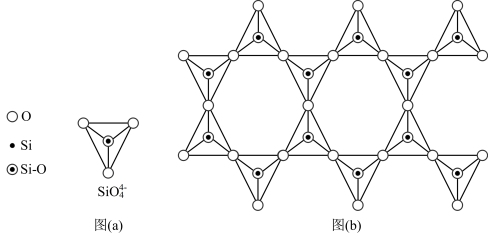
(4)天然硅酸盐组成复杂阴离子的基本结构单元是Si—O四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中Si与O的原子数之比为_______ 。
(5)硫和锌可以制备得ZnS晶体,其晶胞结构如图甲所示,晶胞中 和
和 的投影位置如图乙所示。
的投影位置如图乙所示。
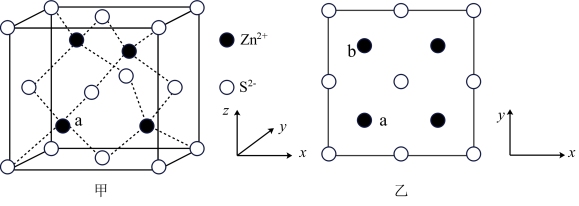
①Zn2+的电子排布式为_______ ,每个Zn2+周围距离最近的 有
有_______ 个。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。例如,a位置的 的坐标为(
的坐标为( ,
, ,
, ),则b位置的
),则b位置的 在图甲中对应的坐标为
在图甲中对应的坐标为_______ 。
③若a、b位置 的空间距离为a pm(核间距),设阿伏加德罗常数的值为
的空间距离为a pm(核间距),设阿伏加德罗常数的值为 ,则ZnS晶体的密度为
,则ZnS晶体的密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)已知
 熔沸点较低,常温下呈液态,易溶于有机溶剂,则
熔沸点较低,常温下呈液态,易溶于有机溶剂,则 晶体为
晶体为 中含有
中含有 键。
键。(2)某配合物化学式为
 ,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量
,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量 溶液,产生2mol白色沉淀,则其中Co的化合价为
溶液,产生2mol白色沉淀,则其中Co的化合价为(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为

(4)天然硅酸盐组成复杂阴离子的基本结构单元是Si—O四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中Si与O的原子数之比为

(5)硫和锌可以制备得ZnS晶体,其晶胞结构如图甲所示,晶胞中
 和
和 的投影位置如图乙所示。
的投影位置如图乙所示。
①Zn2+的电子排布式为
 有
有②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。例如,a位置的
 的坐标为(
的坐标为( ,
, ,
, ),则b位置的
),则b位置的 在图甲中对应的坐标为
在图甲中对应的坐标为③若a、b位置
 的空间距离为a pm(核间距),设阿伏加德罗常数的值为
的空间距离为a pm(核间距),设阿伏加德罗常数的值为 ,则ZnS晶体的密度为
,则ZnS晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次



