名校
解题方法
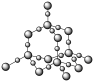
1 . 观察下列结构示意图并结合相关信息,判断有关说法不正确的是
| 玛瑙 | 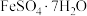 | 18-冠-6 |  |
|
|
|
|
A.玛瑙,又名马脑、码瑙或马瑙,属于共价晶体,且两种原子个数比为 |
B.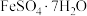 结构中键角1、2、3由大到小的顺序: 结构中键角1、2、3由大到小的顺序: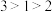 |
C.18-冠-6中O(灰球)电负性大,带负电荷,通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
D.固态硫 中S原子均为 中S原子均为 杂化 杂化 |
您最近一年使用:0次
2 . 钛酸钙矿物的晶体结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为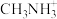 ,另两种离子为
,另两种离子为 和
和 。下列说法不正确的是
。下列说法不正确的是
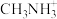 ,另两种离子为
,另两种离子为 和
和 。下列说法不正确的是
。下列说法不正确的是
A.钛酸钙晶体中离 最近的 最近的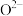 有12个 有12个 |
B.图(b)中,X为 |
C.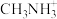 中 中 键角大于 键角大于 中 中 键角 键角 |
D.钛酸钙晶体中离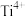 最近的 最近的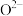 形成了正八面体, 形成了正八面体,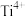 位于其中心 位于其中心 |
您最近一年使用:0次
名校
解题方法
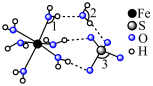
3 . 铁及其化合物在生产生活中应用非常广泛.回答下列问题:
(1)铁元素位于周期表第四周期第____________ 族;下列状态的铁中,电离最外层一个电子所需能量最大的是____________ (填标号). 的含量,适宜
的含量,适宜 范围为2~9,反应原理为
范围为2~9,反应原理为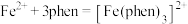 .邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
.邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
(3)铁的一种配合物的化学式为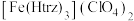 ,配体
,配体 为三氮唑(
为三氮唑(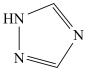 ).
).
① 的键角
的键角____________ (填“等于”、“大于”或“小于”) 的键角.
的键角. 的VSEPR模型为
的VSEPR模型为____________ .
②Htrz分子为平面结构, 原子的杂化轨道类型为
原子的杂化轨道类型为____________ ,连接氢原子的氮原子在形成Htrz分子中的大 键时提供的电子数是
键时提供的电子数是____________ .
(1)铁元素位于周期表第四周期第
A.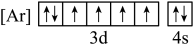 B.
B.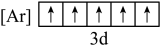
C. 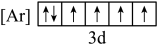 D.
D.
 的含量,适宜
的含量,适宜 范围为2~9,反应原理为
范围为2~9,反应原理为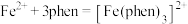 .邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
.邻二氮菲(平面形)与琥珀酸亚铁结构简式如图.下列说法正确的是____________.
| A.琥珀酸不具有旋光性 |
B. 中, 中, 的配位数为3 的配位数为3 |
C.当 时,邻二氮菲中的 时,邻二氮菲中的 会优先与 会优先与 形成配位键 形成配位键 |
D.邻二氮菲中 原子的孤电子对占据 原子的孤电子对占据 轨道 轨道 |
(3)铁的一种配合物的化学式为
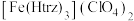 ,配体
,配体 为三氮唑(
为三氮唑( ).
).①
 的键角
的键角 的键角.
的键角. 的VSEPR模型为
的VSEPR模型为②Htrz分子为平面结构,
 原子的杂化轨道类型为
原子的杂化轨道类型为 键时提供的电子数是
键时提供的电子数是
您最近一年使用:0次
名校
解题方法
4 . 下列关于物质的结构或性质的描述及解释都正确的是
| A.沸点:对羟基苯甲醛>邻羟基苯甲醛,是由于对羟基苯甲醛分子间范德华力更强 |
B.键角: 是由于 是由于 中 中 上孤电子对数比 上孤电子对数比 分中 分中 上的少 上的少 |
C.已知: 元素和 元素和 元素的电负性差值大于 元素的电负性差值大于 元素和 元素和 元素的电负性差值,故: 元素的电负性差值,故: 分子的极性大于 分子的极性大于 |
D.稳定性: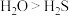 ,是由于水分子间存在氢键 ,是由于水分子间存在氢键 |
您最近一年使用:0次
名校
5 . 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A. 键的键能小于 键的键能小于 键的键能 键的键能 |
B. 键角比 键角比 小 小 |
| C.氟化氢分子的极性强于氯化氢分子的极性 |
D.气态氟化氢中存在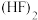 ,而气态氯化氢中是 ,而气态氯化氢中是 分子 分子 |
您最近一年使用:0次
名校
6 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子在不同状态下的电子排布式有以下几种,其中处于激发态且能量较高的是___________ 。(填标号)
a. b.
b. c.
c. d.
d.
(2)①一氯乙烯(C2H3Cl)分子中,C的一个___________ 杂化轨道与Cl的3px轨道形成C-Cl___________ 键,并且Cl的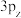 轨道与C的
轨道与C的 轨道形成3中心4电子的大π键
轨道形成3中心4电子的大π键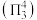 。
。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是___________ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C-Cl键越强;(ⅱ)___________ 。
(1)氟原子在不同状态下的电子排布式有以下几种,其中处于激发态且能量较高的是
a.
 b.
b. c.
c. d.
d.
(2)①一氯乙烯(C2H3Cl)分子中,C的一个
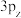 轨道与C的
轨道与C的 轨道形成3中心4电子的大π键
轨道形成3中心4电子的大π键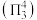 。
。②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是
您最近一年使用:0次
7 . 科技的发展为新能源开发和新材料研制开拓出更大的空间。中科院科学家最近合成了一种新型材料,其结构简式为:___________ 种空间伸展方向;基态硒原子的价层电子排布式是___________ ;氟、氧、氮三种元素的第一电离能由大到小的顺序___________ (用元素符号表示)。
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它___________ (填“能”或“不能”)形成分子内或者分子间氢键,其原因是___________ 。
(3)硒能形成两种常见的氧化物,分子式为___________ 。
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是___________ 。
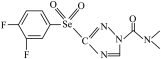
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它
(3)硒能形成两种常见的氧化物,分子式为
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是
您最近一年使用:0次
名校
8 . 下列有关 等含氮粒子的说法正确的是
等含氮粒子的说法正确的是
 等含氮粒子的说法正确的是
等含氮粒子的说法正确的是A. 中 中 键角比 键角比 中 中 键角大 键角大 |
B. 极易溶于水,主要原因是 极易溶于水,主要原因是 分子间能形成氢键 分子间能形成氢键 |
C. 的水溶液能导电,但不能完全电离,因此 的水溶液能导电,但不能完全电离,因此 属于弱电解质 属于弱电解质 |
D.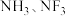 的空间结构都是三角锥形, 的空间结构都是三角锥形,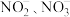 中的 中的 都是 都是 杂化 杂化 |
您最近一年使用:0次
名校
解题方法
9 . 黄砷(As4)是砷元素的一种单质,其分子结构与白磷(P4)相似。下列关于黄砷和白磷的叙述正确的是
| A.黄砷分子中共价键键角为109.5° | B.黄砷分子比白磷分子更稳定 |
| C.砷是VIA族元素 | D.黄砷的熔点高于白磷 |
您最近一年使用:0次
名校
10 . 氮族元素(N、P、As、Sb等)及其化合物在工农业生产、环境等方面有重要应用和影响。
Ⅰ.氮族元素氢化物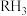 (
( 、
、 、
、 )的某种性质随R的核电荷数的Y变化趋势如图所示。
)的某种性质随R的核电荷数的Y变化趋势如图所示。
(1)Y轴可表示的氢化物(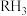 )性质可能是
)性质可能是________ 。
Ⅱ.磷化氢( )是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。
)是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。________ 。
(3)白磷和烧碱溶液反应的化学方程式为________ ,次磷酸属于________ (填“一”“二”或“三”)元酸。
(4)若起始时有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成________  (忽略产物的损失)。
(忽略产物的损失)。
(5)释放到大气中的 废气,可与
废气,可与 类温室气体竞争羟基自由基·OH,通过
类温室气体竞争羟基自由基·OH,通过 反应不断被消耗,进而减缓了大气中通过
反应不断被消耗,进而减缓了大气中通过 反应对
反应对 类温室气体进行化学清除的速率。请从物质结构角度解释
类温室气体进行化学清除的速率。请从物质结构角度解释 对·OH更具竞争优势的原因
对·OH更具竞争优势的原因________ 。
(6)用Ni/ /
/ 催化剂催化分解
催化剂催化分解 机理如下,实现了污染物资源化转化。
机理如下,实现了污染物资源化转化。________ 。
Ⅲ.雄黄( )、雌黄(
)、雌黄( )都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。
)都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。________ (填“是”或“否”)
(8)已知雌黄分子中没有π键且各原子最外层均达到8电子稳定结构,由此判断雌黄在水中的溶解性为________ (填“可溶”或“不溶”),原因是________ 。
Ⅰ.氮族元素氢化物
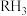 (
( 、
、 、
、 )的某种性质随R的核电荷数的Y变化趋势如图所示。
)的某种性质随R的核电荷数的Y变化趋势如图所示。(1)Y轴可表示的氢化物(
 )性质可能是
)性质可能是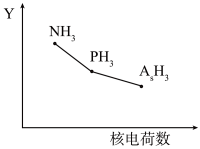
Ⅱ.磷化氢(
 )是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。
)是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。
(3)白磷和烧碱溶液反应的化学方程式为
(4)若起始时有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成 (忽略产物的损失)。
(忽略产物的损失)。(5)释放到大气中的
 废气,可与
废气,可与 类温室气体竞争羟基自由基·OH,通过
类温室气体竞争羟基自由基·OH,通过 反应不断被消耗,进而减缓了大气中通过
反应不断被消耗,进而减缓了大气中通过 反应对
反应对 类温室气体进行化学清除的速率。请从物质结构角度解释
类温室气体进行化学清除的速率。请从物质结构角度解释 对·OH更具竞争优势的原因
对·OH更具竞争优势的原因(6)用Ni/
 /
/ 催化剂催化分解
催化剂催化分解 机理如下,实现了污染物资源化转化。
机理如下,实现了污染物资源化转化。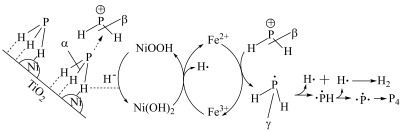
Ⅲ.雄黄(
 )、雌黄(
)、雌黄( )都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。
)都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。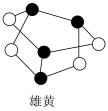
(8)已知雌黄分子中没有π键且各原子最外层均达到8电子稳定结构,由此判断雌黄在水中的溶解性为
您最近一年使用:0次