名校
解题方法
1 . 工业上采用还原法冾炼黄金(Au)的原理如下:


请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为___________ ,金元素位于___________ 区。
(2)Zn和Cu相邻,第一电离能:I1(Cu)___________ (填“>”、“<”或“=”,下同)I1(Zn),第二电离能:I2(Cu)___________ I2(Zn)。
(3)1mol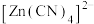 中含
中含___________ molσ键。
(4)已知卤化锌的熔点如下表所示:
卤化锌的熔点存在差异的主要原因是___________ 。
(5)由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为___________ ,其中金原子形成了2种不同的配离子(均呈负一价),它们分别是___________ 和___________ (写出离子符号,不分顺序)。

(6)金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为___________ (只列计算式,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值) 。
。



请回答下列问题:
(1)在元素周期表中,Au与Cu位于同族,基态Au原子比基态Cu原子多2个电子层。基态Au原子的价层电子排布式为
(2)Zn和Cu相邻,第一电离能:I1(Cu)
(3)1mol
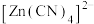 中含
中含(4)已知卤化锌的熔点如下表所示:
| 卤化锌 |  |  | 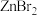 | 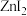 |
| 熔点/℃ | 872 | 283 | 394 | 446 |
(5)由金、氯、铯三种元素组成的晶体M,其晶胞结构如图1所示,M的化学式为

(6)金晶体的晶胞结构如图2所示,其晶胞参数为408pm,金晶体的密度为
 为阿伏加德罗常数的值)
为阿伏加德罗常数的值) 。
。
您最近一年使用:0次
2021-12-02更新
|
328次组卷
|
6卷引用:河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题
河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题广东省2021-2022学年高三11月联考化学试题河南省名校联盟2021-2022学年高三上学期11月联考化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)广东省深圳市龙华中学2021-2022学年高三下学期(二月第二次)半周测化学试题
名校
解题方法
2 . 现有下列有机物:A. B.
B. C.
C. D.
D. ,完成下列问题:
,完成下列问题:
(1)A分子中碳原子轨道的杂化类型为_______ 。
(2)1molB分子中含有的σ键的数目为_______ 。
(3)A中官能团的名称是:_______ 。
(4)写出由A制取B的化学方程式:_______ 。
(5)写出A制取C、D两种物质的有机反应类型:A→C:__ 、A→D:___ 。
 B.
B. C.
C. D.
D. ,完成下列问题:
,完成下列问题:(1)A分子中碳原子轨道的杂化类型为
(2)1molB分子中含有的σ键的数目为
(3)A中官能团的名称是:
(4)写出由A制取B的化学方程式:
(5)写出A制取C、D两种物质的有机反应类型:A→C:
您最近一年使用:0次
名校
3 . 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图,下列说法错误的是
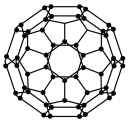

| A.分子中碳原子轨道的杂化类型为sp2杂化 |
| B.1molC60分子中σ键的数目为90NA |
| C.1个C60分子中含有20个五边形和12个六边形 |
| D.C60分子晶胞是分子密堆积 |
您最近一年使用:0次
2021-09-09更新
|
1640次组卷
|
4卷引用:河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题
名校
4 . 用NA表示阿伏加德罗常数的值。下列说法中正确的是
| A.124g白磷中含有P-P键的个数为4NA |
| B.40g金刚砂中含有Si-C键的个数为2NA |
| C.28g晶体硅中含有Si-Si键的个数为4NA |
| D.60gSiO2中含有Si-O键的个数为4NA |
您最近一年使用:0次
5 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.0.1mol乙烯中含有的共用电子对数目为0.6NA |
| B.14g聚乙烯中含有的π键数目为0.5NA |
| C.1mol甲酸与足量乙醇充分反应后,生成的甲酸乙酯分子数目为NA |
| D.11.2L乙炔与氢气的混合物中含有的氢原子数目为NA |
您最近一年使用:0次
名校
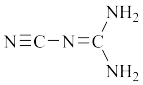
6 . 某物质可溶于水、乙醇,熔点为 ,其分子的结构简式如图所示。下列说法不正确的是
,其分子的结构简式如图所示。下列说法不正确的是
 ,其分子的结构简式如图所示。下列说法不正确的是
,其分子的结构简式如图所示。下列说法不正确的是
| A.该分子中含有极性共价键 |
B. 该物质中 该物质中 键和 键和 键的个数比为 键的个数比为 |
| C.该分子中原子最外层均达到8电子稳定结构的为C、N |
| D.该分子中的共价键按原子轨道重叠方式划分为3种 |
您最近一年使用:0次
解题方法
7 . 德国科学家发现新配方:他使用了远古地球上存在的 、
、 、
、 、
、 、
、 和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法不正确的是
和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法不正确的是
 、
、 、
、 、
、 、
、 和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法不正确的是
和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法不正确的是A.基态 价电子排布为 价电子排布为 | B. 、 、 、 、 分子间均存在氢键 分子间均存在氢键 |
C. 、 、 、HCN中均存在 、HCN中均存在 键和 键和 键 键 | D.沸点: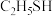 (乙硫醇)> (乙硫醇)> |
您最近一年使用:0次
解题方法
8 . 《化学世界》刊载了我国科学家的研究成果:在钴锰氧化物(Co,Mn)3O4的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。
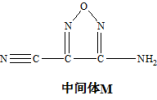
回答下列问题:
(1)基态钴原子价层电子排布式为___ 。基态锰原子有___ 种空间运动状态不同的电子。
(2)中间体M分子中,碳原子的杂化类型是___ 。
(3)Co3+、Co2+能与NH3、H2O、SCN-等配体组成配合物。
①1 mol [Co(NH3)6]3+含σ键数目为___ 。
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式[S=C=N]-,SCN-与金属离子形成的配合物中配位原子是___ 。
(4)第三电离能(I3):Mn>Fe,理由是___ 。
(5)KMnF3晶体有钙钛矿型的立方结构,晶胞结构如图1所示。
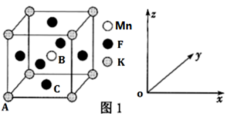
①若原子坐标参数A为(0,0,0);B为( ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为___ 。
②若阿伏加德罗常数的值为NA,晶胞参数为a nm,则晶体密度为___ g•cm-3。
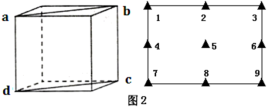
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为___ (填阿拉伯数字序号)。

回答下列问题:
(1)基态钴原子价层电子排布式为
(2)中间体M分子中,碳原子的杂化类型是
(3)Co3+、Co2+能与NH3、H2O、SCN-等配体组成配合物。
①1 mol [Co(NH3)6]3+含σ键数目为
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式[S=C=N]-,SCN-与金属离子形成的配合物中配位原子是
(4)第三电离能(I3):Mn>Fe,理由是
(5)KMnF3晶体有钙钛矿型的立方结构,晶胞结构如图1所示。


①若原子坐标参数A为(0,0,0);B为(
 ,
, ,
, ),则C原子的坐标参数为
),则C原子的坐标参数为②若阿伏加德罗常数的值为NA,晶胞参数为a nm,则晶体密度为
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为
您最近一年使用:0次
名校
9 . 我国 排放力争2030年前达到峰值,力争2060年前实现碳中和。有关
排放力争2030年前达到峰值,力争2060年前实现碳中和。有关 的说法不正确的是
的说法不正确的是
 排放力争2030年前达到峰值,力争2060年前实现碳中和。有关
排放力争2030年前达到峰值,力争2060年前实现碳中和。有关 的说法不正确的是
的说法不正确的是A. 的电负性比 的电负性比 的大 的大 |
B. 是由极性键构成的极性分子 是由极性键构成的极性分子 |
C. 中σ键和π键的数目之比为 中σ键和π键的数目之比为 |
D.相同压强下, 的熔点比 的熔点比 的低 的低 |
您最近一年使用:0次
2021-06-09更新
|
544次组卷
|
5卷引用:河北省邢台市2020-2021学年高二下学期第三次月考化学试题
10 . 钴及其化合物在生产生活中有广泛的应用。回答下列问题:
(1)基态钴原子价电子排布式为___ 。
(2)Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为___ 。
(3)[Co(NO )4]2-中Co2+的配位数为4,配体中N的杂化方式为
)4]2-中Co2+的配位数为4,配体中N的杂化方式为___ ,该配离子中各元素I1由小到大的顺序为___ (填元素符号),1mol该配离子中含σ键数目为__ NA。
(4)八面体CoCl3·3NH3结构有__ 种,其中极性分子有___ 种。
(1)基态钴原子价电子排布式为
(2)Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为
(3)[Co(NO
 )4]2-中Co2+的配位数为4,配体中N的杂化方式为
)4]2-中Co2+的配位数为4,配体中N的杂化方式为(4)八面体CoCl3·3NH3结构有
您最近一年使用:0次



