名校
解题方法
1 . 氰气的化学式为(CN)2,结构式为 ,性质与卤素相似,下列叙述正确的是
,性质与卤素相似,下列叙述正确的是
 ,性质与卤素相似,下列叙述正确的是
,性质与卤素相似,下列叙述正确的是| A.在一定条件下可发生加成反应 |
B.分子中 键的键长大于 键的键长大于 键的键长 键的键长 |
| C.分子中含有2个σ键和4个π键 |
| D.不和氢氧化钠溶液发生反应 |
您最近一年使用:0次
2024-01-07更新
|
107次组卷
|
2卷引用:内蒙古自治区赤峰市2020-2021学年高一下学期期末联考化学试题
名校
解题方法
2 . 乙炔是有机合成工业的一种重要原料。工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔。
(1)焦炭、金刚石和C60都是碳的单质。已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为140~145pm ,二者比较熔点高的是_______ ,理由是_______ 。
(2)乙炔与氢氰酸反应可得丙烯腈 ,丙烯腈分子中碳原子轨道杂化类型是
,丙烯腈分子中碳原子轨道杂化类型是_______ ,该分子中 键与
键与 键个数比为
键个数比为_______ 。
(3)将乙炔通入 溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为_______ ; 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:_______ 。
(4)CaC2中C 与O
与O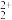 互为等电子体,O
互为等电子体,O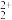 的电子式为
的电子式为_______ 。
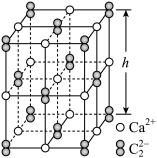
(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形C 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C 有
有_______ 个;已知CaC2晶体密度为 ,晶胞中两个C
,晶胞中两个C 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=_______ cm。
(6)钾和铜都是第四周期元素,且原子的最外层电子数相同,铜的熔沸点远大于钾的原因是_______ 。
(7)CuSO4·5H2O结构示意图如下,CuSO4·5H2O中存在的相互作用有_______ (填序号,下同),加热该蓝色胆矾晶体得到白色硫酸铜固体破坏的相互作用有_______ 。

A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(1)焦炭、金刚石和C60都是碳的单质。已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为140~145pm ,二者比较熔点高的是
(2)乙炔与氢氰酸反应可得丙烯腈
 ,丙烯腈分子中碳原子轨道杂化类型是
,丙烯腈分子中碳原子轨道杂化类型是 键与
键与 键个数比为
键个数比为(3)将乙炔通入
 溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:(4)CaC2中C
 与O
与O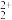 互为等电子体,O
互为等电子体,O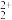 的电子式为
的电子式为(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形C
 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的C 有
有 ,晶胞中两个C
,晶胞中两个C 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
(6)钾和铜都是第四周期元素,且原子的最外层电子数相同,铜的熔沸点远大于钾的原因是
(7)CuSO4·5H2O结构示意图如下,CuSO4·5H2O中存在的相互作用有

A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
您最近一年使用:0次
名校
3 . 下列说法中不正确的是
A. 键比 键比 键重叠程度大,形成的共价键通常更牢固 键重叠程度大,形成的共价键通常更牢固 |
B.两个原子之间形成共价键时,最多有一个 键 键 |
C.气体单质中,一定有 键,可能有 键,可能有 键 键 |
D. 分子中有一个 分子中有一个 键,2个 键,2个 键 键 |
您最近一年使用:0次
2023-04-08更新
|
231次组卷
|
87卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 第1课时 共价键
(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 第1课时 共价键鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第1节 共价键模型 第1课时 共价键的形成(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第1节 共价键模型高二选择性必修2(人教版2019)第二章 分子结构与性质 第一节综合训练(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)2.1 共价键(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题甘肃省兰州市第一中学2020-2021学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高二下学期期中考试化学试题江苏省南通市如皋中学2020-2021学年高一下学期第二次阶段考试化学试题吉林省乾安县第七中学2020-2021学年高二下学期第六次质量检测化学试题福建省仙游县枫亭中学2020-2021学年高二下学期期中考试化学试题辽宁省鞍山市2020-2021学年高二下学期期末考试化学试题江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题(已下线)2.1.1 共价键的类型-σ键和π键-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2010-2011学年福建省师大附中高二下学期期中考试化学试卷(已下线)2011-2012学年新疆农七师高级中学高二下学期期末考试试化学试卷(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2012-2013学年辽宁葫芦岛第一高级中学高二下学期期中考试化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2012-2013学年湖北省荆州市监利县柘木中学高二下第二次月考化学卷2015-2016学年河北省邢台一中高二上12月月考化学试卷2015-2016学年四川省成都市新都一中高二下4月月考化学试卷福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题高中化学人教版 选修三 第2章 分子结构与性质 共价键宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.1 第1课时黑龙江省齐齐哈尔市第八中学2017-2018学年高二3月月考化学试题云南省香格里拉县一中2018-2019学年高二上学期期中考试化学试题贵州省普定县一中2018-2019学年高二上学期期中考试化学试题贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题贵州省毕节市黔西县第一中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】河北省衡水市武邑中学2018-2019学年高二12月月考化学试题云南省普洱市景东县第一中学2018-2019学年高二上学期期末考试化学试题云南省玉溪市江川区第二中学2018-2019学年高二上学期期末考试化学试题【全国百强校】山西省实验中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题河北省唐山市开滦第二中学2018-2019学年高二下学期期中考试化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题广西蒙山县第一中学2017-2018学年高二下学期期末考试化学试题云南省通海三中2018-2019学年高二下学期6月份考试化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题新疆乌鲁木齐市第四中学2018-2019学年高二下学期期末考试化学试题云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题广西壮族自治区蒙山县第一中学2019-2020学年高二下学期期末考试化学试题广西蒙山一中2018-2019学年高二下学期期末考试化学试题(已下线)专题11.2 分子结构与性质(讲)-《2020年高考一轮复习讲练测》云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题江苏省徐州一中2019-2020学年高二上学期期末调研测试化学试题云南省丽江市永胜县第二中学2019—2020学年高二上学期期末考试化学试题河南省洛阳市2019-2020学年高二上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高二上学期期末考试化学试题宁夏回族自治区吴忠市吴忠中学2020年高二化学人教版选修3《物质结构与性质》综合测试山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题河北省正定中学2019-2020学年高二3月线上月考化学试题湖北省武汉市武昌区水果湖高中 2019-2020 学年高二下学期期中考试化学试题陕西省宝鸡市渭滨区2018-2019学年高二下学期期末考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期线上检测化学试题山东省泰安市2020年高二下学期化学期中考试(鲁科版)山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题河北省沧州市任丘市第一中学2019-2020学年高二6月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题(已下线)练习19 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版)黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题(已下线)2.1.1 共价键的类型——σ键和π键(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题浙江省台州市三门启超中学等两校2021-2022学年高二下学期期中联考化学试题海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题内蒙古赤峰二中2021-2022学年高二下学期第二次月考化学试题专题3 微粒间作用力与物质性质 第三单元 共价键共价晶体 第1课时 共价键的形成及类型湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题湖北省十堰市普通高中协作体2022-2023学年高二下学期3月月考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题3.3.1共价键的形成和类型 课中湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
4 . 下表是元素周期表的一部分,其中的字母编号代表对应的元素。试回答问题:
(1)元素⑦的原子结构示意图为_______ ,元素⑨价电子的轨道表示式为 _______ 。
(2)元素④基态原子核外共有_______ 种不同运动状态的电子,未成对电子数共有_______ 个。
(3)元素③的最简单氢化物分子的空间构型为_______ ,该氢化物含有_______ (填“极性”或“非极性”)键。
(4)③④⑤三种元素的原子电负性由小到大的顺序是_______ (用元素符号表示)。
(5)⑤⑥⑧三种元素的原子半径由大到小的顺序是_______ (用元素符号表示)。
(6)由元素⑩形成的1mol晶体中,含有的共价键为_______ mol。
| ① | ② | ③ | ④ | ⑤ | |||||||||||||
| ⑥ | ⑦ | ⑩ | ⑧ | ||||||||||||||
| ⑨ | |||||||||||||||||
(2)元素④基态原子核外共有
(3)元素③的最简单氢化物分子的空间构型为
(4)③④⑤三种元素的原子电负性由小到大的顺序是
(5)⑤⑥⑧三种元素的原子半径由大到小的顺序是
(6)由元素⑩形成的1mol晶体中,含有的共价键为
您最近一年使用:0次
5 . 下列叙述不正确的是
| A.金刚石、金刚砂(SiC)、冰、干冰晶体的熔点依次降低 |
B.水晶( )和干冰在熔化时,晶体中的共价键都会断裂 )和干冰在熔化时,晶体中的共价键都会断裂 |
| C.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点 |
| D.乙炔分子中σ键与π键的数目比为3:2 |
您最近一年使用:0次
6 . 某水合氨基酸锌结构如图所示。下列说法正确的是
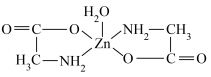

A.中子数为10的氧原子可表示为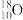 |
B.第一电离能: |
C.基态 的核外电子排式为 的核外电子排式为 |
D.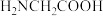 分子中含有8个 分子中含有8个 键 键 |
您最近一年使用:0次
2022·湖南·高考真题
7 . 铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
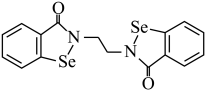
①基态 原子的核外电子排布式为
原子的核外电子排布式为
_______ ;
②该新药分子中有_______ 种不同化学环境的C原子;
③比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(2)富马酸亚铁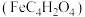 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
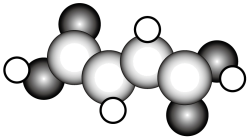
①富马酸分子中 键与
键与 键的数目比为
键的数目比为_______ ;
②富马酸亚铁中各元素的电负性由大到小的顺序为_______ 。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将
,将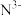 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:

①产物中N原子的杂化轨道类型为_______ ;
②与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
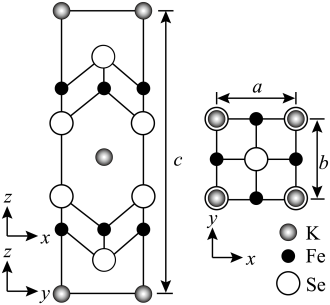
①该超导材料的最简化学式为_______ ;
②Fe原子的配位数为_______ ;
③该晶胞参数 、
、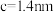 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ 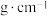 (列出计算式)。
(列出计算式)。
 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①基态
 原子的核外电子排布式为
原子的核外电子排布式为
②该新药分子中有
③比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)富马酸亚铁
 是一种补铁剂。富马酸分子的结构模型如图所示:
是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中
 键与
键与 键的数目比为
键的数目比为②富马酸亚铁中各元素的电负性由大到小的顺序为
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化
 ,将
,将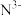 转化为
转化为 ,反应过程如图所示:
,反应过程如图所示:
①产物中N原子的杂化轨道类型为
②与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数
 、
、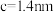 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为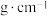 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-06-10更新
|
7994次组卷
|
10卷引用:专题九 物质结构与性质-实战高考·二轮复习核心突破
(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题19 物质结构与性质综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
名校
解题方法
8 . 设阿伏加德罗常数的值为NA,下列结论错误 的是
A.完全电解 断裂的 断裂的 键键数为4NA 键键数为4NA |
B.标准状况下,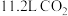 中含有的 中含有的 键键数为2NA 键键数为2NA |
C.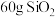 晶体中含有的Si-O键键数为4NA 晶体中含有的Si-O键键数为4NA |
D. 的水溶液中加入 的水溶液中加入 溶液,不能生成 溶液,不能生成 沉淀 沉淀 |
您最近一年使用:0次
名校
解题方法
9 . 已知吡咯中的各个原子均在同一平面内,其结构如下图所示,则下列关于吡咯的说法正确的是


| A.吡咯的分子式为C4HN |
| B.分子中含10个σ键 |
| C.分子中只有极性键 |
D.分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键中电子数,则吡咯的大π键应表示为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键中电子数,则吡咯的大π键应表示为 |
您最近一年使用:0次
2022-04-22更新
|
95次组卷
|
2卷引用:陕西省陕西师范大学附属中学2020-2021学年高二下学期期中考试化学试题
名校
解题方法
10 . Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,下列说法正确的是
| A.此化学方程式中涉及的第二周期元素的电负性由大到小的顺序为N>O>C |
B.配合物K4Fe(CN)6的中心离子的价电子排布图为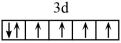 ,该中心离子的配位数是10 ,该中心离子的配位数是10 |
| C.1molHCN分子中含有σ键的数目为1.204×1024,HCN分子中碳原子轨道杂化类型是sp杂化 |
| D.K2CO3中阴离子的空间构型为三角锥形,其中碳原子的价层电子对数为4 |
您最近一年使用:0次
2022-04-12更新
|
136次组卷
|
2卷引用:江苏省海安高级中学2021-2022学年高二上学期阶段测试(二)化学试题



