名校
解题方法
1 . 现有周期表中前四周期的五种元素A、B、C、D、E,其中A、B、C为金属且位于同一周期,原子序数C>B>A;A、C核外均没有未成对电子;B被誉为“21世纪的金属”,B原子核外有二个未成对电子和三个空轨道;D原子最外层电子数是其周期序数的三倍;E能与D形成化合物ED2,可用于自来水的消毒。
(1)B元素基态原子的电子排布式为_______ ,E元素在周期表中的位置为_______ 。
(2)化合物E2D分子的立体构型为________ ,中心原子采用_______ 杂化。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:136.4℃。则该化合物属于____ 晶体,晶体内含有的作用力类型有_______ 。
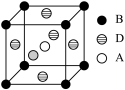
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______ 。若最近的B 与D的原子距离为acm,该物质的摩尔质量为Mg/mol,阿伏伽德罗常数的数值为NA,则该晶体的密度为_______ g/cm3。
(1)B元素基态原子的电子排布式为
(2)化合物E2D分子的立体构型为
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:136.4℃。则该化合物属于
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为
您最近一年使用:0次
2017-05-19更新
|
318次组卷
|
2卷引用:内蒙古鄂尔多斯市2017届高三模拟考试理综化学试题
名校
2 . 三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在—定条件下直接反应得到:4NH3+3F2 = NF3+3NH4F。下列有关NF3的叙述不正确的是
| A.NF3是一种极性分子 | B.NF3提供孤电子对的能力比NH3强 |
| C.NF3中的N呈+3价 | D.NF3中的N采取sp3杂化成键 |
您最近一年使用:0次
名校
解题方法
3 . 已知A、B、c、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氧化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)B、C、D的第一电离能由小到大的顺序为__________________ 。
(2)B的氢化物的分子空间构型是____________ ,其中心原子采取的杂化方式是________________ 。
(3)写出化合物AC2的电子式______________ ,一种由B、C组成的化合物与AC2互为等电子体,其化学式为_________ 。
(4)ECl3形成的配合物的化学式为______________________ 。
(1)B、C、D的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
(4)ECl3形成的配合物的化学式为
您最近一年使用:0次
4 . 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________ 。
(2)根据元素周期律,原子半径Ga_____________ As,第一电离能Ga____________ As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________ ,其中As的杂化轨道类型为_________ 。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是__________ 。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________ ,Ga与As以________ 键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________ 。

(1)写出基态As原子的核外电子排布式
(2)根据元素周期律,原子半径Ga
(3)AsCl3分子的立体构型为
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

您最近一年使用:0次
2016-12-09更新
|
3901次组卷
|
21卷引用:【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期中考试化学试题
【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期中考试化学试题2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷四川省眉山中学2016-2017学年高二下学期期中考试理综化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题四川省绵阳中学实验学校2017届高三5月模拟理综化学试题河南省南阳市第一中学2018届高三实验班第一次考试化学试题贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题吉林省实验中学2018高三一模理综化学试题【全国校级联考】四川省眉山一中办学共同体2019届高三9月月考化学试题吉林省实验中学2018届高三上学期第五次月考(一模)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题【全国百强校】江西省南昌市第十中学2019届高三上学期期末考试理科综合化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)2020届高中化学第一轮复习第十二章《物质结构与性质》测试卷湖北省武汉市华中师范大学第一附属中学2020届高三2月份网络教学质量监测理综化学试题广西壮族自治区田阳高中2019-2020学年高二下学期6月月考理科综合化学试题福建省永安市第三中学2021届高三9月月考化学试题广西河池市高级中学2021-2022学年高三上学期第三次月考化学试题湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
名校
解题方法
5 . 2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:
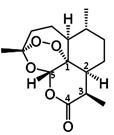
(1)组成青蒿素的三种元素电负性由大到小排序是________ ,在基态O原子中,核外存在_______ 对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是____________ (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
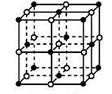
① NaH为___________ 晶体,右图是NaH晶胞结构,则NaH晶体的配位数是_______ ,若晶胞棱长为a则Na原子间最小核间距为________ 。
② B(OCH3)3 中B采用的杂化类型是_____________ 。写出两个与B(OCH3)3 具有相同空间构型的分子或离子______________ 。
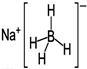
③ NaBH4结构如图所示。结构中存在的作用力有________________ 。

(1)组成青蒿素的三种元素电负性由大到小排序是
(2)下列关于青蒿素的说法正确的是
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
① NaH为

② B(OCH3)3 中B采用的杂化类型是
③ NaBH4结构如图所示。结构中存在的作用力有

您最近一年使用:0次
2016-12-09更新
|
237次组卷
|
3卷引用:2016届内蒙古杭锦后旗奋斗中学高三下第二次模拟化学试卷
解题方法
6 . 选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________ ,离子化合物YX5的电子式是_________ 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是_________ 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
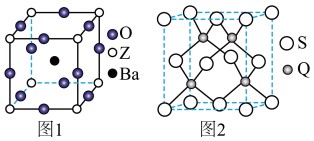
①制备A的化学反应方程式是___________________ ;
②在A晶体中,Z的配位数为__________ ;
(4)R2+离子的外围电子层电子排布式为__________ 。R2O的熔点比R2S的_________ (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为_________ g•cm﹣3(列式并计算)。
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。

①制备A的化学反应方程式是
②在A晶体中,Z的配位数为
(4)R2+离子的外围电子层电子排布式为
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为
您最近一年使用:0次
2010·陕西·一模
7 . 石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是________ 。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为________ 。
②乙醇沸点比氯乙烷高,主要原因是_______________________ 。
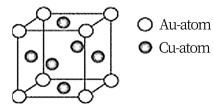
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:________ 。
④含碳原子且属于非极性分子的是________ ;
a.甲烷 b.乙炔 c.苯 d.乙醇
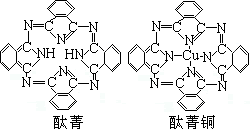
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________ 。

(1)下列有关石墨烯说法正确的是
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为
②乙醇沸点比氯乙烷高,主要原因是
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:

④含碳原子且属于非极性分子的是
a.甲烷 b.乙炔 c.苯 d.乙醇
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:

您最近一年使用:0次
2018-07-17更新
|
133次组卷
|
3卷引用:【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题(已下线)2010年陕西省五校高三第一次模拟考试理综化学试题山东省济南市高新区新2019-2020学年高三化学一轮复习《物质结构与性质》专题测试
解题方法
8 . 下表为周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是_____________ (填编号)。
(2)写出元素⑨的基态原子的电子排布式_____________ ;
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为_____________ 对,其单质的电子式为_____________ ;
(4)元素④的氢化物的分子构型为_____________ ,中心原子的杂化方式为_____________ ;
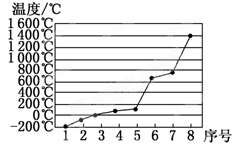
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_____________ (填元素符号);其中电负性最大的是_____________ (填图中的序号)。

请回答下列问题:
(1)表中属于d区的元素是
(2)写出元素⑨的基态原子的电子排布式
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为
(4)元素④的氢化物的分子构型为
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表

您最近一年使用:0次
9 . 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。

(a)石墨烯结构(b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________ 。
(2)图(b)中,1号C的杂化方式是________ ,该C与相邻C形成的键角________ (填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有____________ (填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该材料的化学式为______________ 。

(5)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体: )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为____________ 。
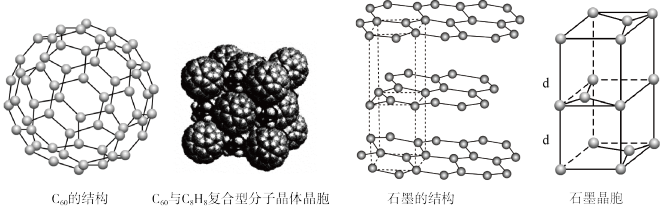
(6)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____________ 个。已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为____________ cm。

(a)石墨烯结构(b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为
(2)图(b)中,1号C的杂化方式是
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该材料的化学式为

(5)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
(6)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为
您最近一年使用:0次
名校
解题方法
10 . 【化学——选修3:物质结构与性质】
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________ 。
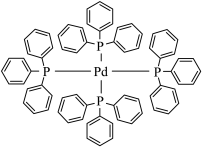
(2)四(三苯基膦)钯分子结构如下图:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___________ ;判断该物质在水中溶解度并加以解释_______________________ 。该物质可用于右上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________________ ;一个A分子中手性碳原子数目为__________________ 。
(3)在图示中表示出四(三苯基膦)钯分子中配位键:_____________
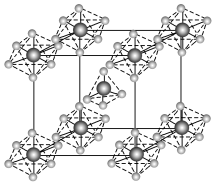
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为_____________________ ;正四面体形阳离子中键角小于PCl3的键角原因为__________________ ;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏加德罗常数的值,则该晶体的密度为_______ g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________ 。
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为
(2)四(三苯基膦)钯分子结构如下图:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为
(3)在图示中表示出四(三苯基膦)钯分子中配位键:


(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因
您最近一年使用:0次
2016-12-09更新
|
227次组卷
|
5卷引用:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷



