解题方法
1 . 铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于_______ 区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有_______ 种。
(2)过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)x中,x=_______ 。
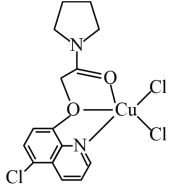
(3)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为_______ ,1mol 该有机配体与Cu( II )形成的配位键为_______ mol。
(4)铜催化烯烃硝化反应时会产生 。键角:
。键角:
_______  (填“<” 或“=”或“>”),其原因是
(填“<” 或“=”或“>”),其原因是_______ 。
(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为_______ ,其中Cu 元素以Cu+和Cu2+存在,则_______ (填“①”或“②”)为Cu2+,该晶体的密度_______ g/cm3 (用含a和c的式子表示,设阿伏伽德罗常数为NA)。

(1)在元素周期表的分区中,铜属于
(2)过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)x中,x=
(3)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为

(4)铜催化烯烃硝化反应时会产生
 。键角:
。键角:
 (填“<” 或“=”或“>”),其原因是
(填“<” 或“=”或“>”),其原因是(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为

您最近一年使用:0次
名校
2 . X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰,生成ZW型化合物;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是
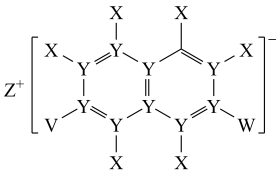

| A.Y与W形成的分子空间结构为三角锥 |
| B.V单质微溶于Y与V组成的二元化合物 |
| C.原子半径的大小关系为:Z>V>W |
| D.热稳定性:X与V组成的二元化合物>X与W组成的二元化合物 |
您最近一年使用:0次
2023-03-22更新
|
419次组卷
|
4卷引用:内蒙古阿拉善盟2023届高三第一次模拟考试理科综合化学试题
内蒙古阿拉善盟2023届高三第一次模拟考试理科综合化学试题宁夏中卫市2022届高三下学期二模理综化学试题(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)河北省张家口市宣化第一中学2022-2023学年高二下学期5月期中化学试题
解题方法
3 . ⅢA、VA族元素组成的化合物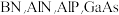 是人工合成的具有特殊功能的新材料,回答下列问题:
是人工合成的具有特殊功能的新材料,回答下列问题:
(1)基态B原子的电子排布式为___________ ;BN中B元素的化合价为___________ 。
(2)As基态原子的电子占据了___________ 个能层,最高能级的电子排布式为___________ ;和As位于同一周期,且未成对电子数也相同的元素还有___________ 种。
(3)元素周期表中与P紧邻的4种元素中电负性最大的是___________ (填元素符号):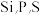 三种元素的第一电离能由大到小的顺序是
三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知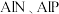 等半导体材料的晶体结构与单晶硅相似,则
等半导体材料的晶体结构与单晶硅相似,则 原子的杂化形式为
原子的杂化形式为___________ ;晶体结构中存在的化学键有___________ (填字母代号)。
A.离子键 B.σ键 C.π键 D.配位键
(5)立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为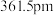 ,立方氮化硼的密度是
,立方氮化硼的密度是___________  (只要求列算式,不必计算出数值,阿伏加德罗常数为
(只要求列算式,不必计算出数值,阿伏加德罗常数为 )。
)。
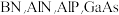 是人工合成的具有特殊功能的新材料,回答下列问题:
是人工合成的具有特殊功能的新材料,回答下列问题:(1)基态B原子的电子排布式为
(2)As基态原子的电子占据了
(3)元素周期表中与P紧邻的4种元素中电负性最大的是
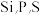 三种元素的第一电离能由大到小的顺序是
三种元素的第一电离能由大到小的顺序是(4)已知
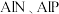 等半导体材料的晶体结构与单晶硅相似,则
等半导体材料的晶体结构与单晶硅相似,则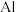 原子的杂化形式为
原子的杂化形式为A.离子键 B.σ键 C.π键 D.配位键
(5)立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为
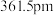 ,立方氮化硼的密度是
,立方氮化硼的密度是 (只要求列算式,不必计算出数值,阿伏加德罗常数为
(只要求列算式,不必计算出数值,阿伏加德罗常数为 )。
)。
您最近一年使用:0次
名校
4 . X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Y原子为其所在周期中未成对电子最多的原子,下列说法中正确的是
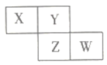

A. 的空间构型为V形 的空间构型为V形 |
| B.Y的最简单气态氢化物的水溶液显碱性 |
| C.Z的氯化物中各原子最外层一定满足8电子稳定结构 |
| D.W的氧化物对应水化物的酸性比Z的氧化物对应水化物的酸性强 |
您最近一年使用:0次
2021-07-04更新
|
125次组卷
|
4卷引用:内蒙古阿拉善盟第一中学2020-2021学年高二上学期第一次段考化学试题
解题方法
5 . 随新能源汽车的发展,新能源电池技术也在不断创新,典型的锂离子电池一般以LiCoO2或LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LiPF6等的有机溶液为电解质溶液。
(1)P原子的电子排布式为_________ 。Fe2+中未成对电子数为___________ 。
(2)N、O、F原子的第一电离能由小到大的顺序为_______ 。
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为_______ ,中心原子的杂化轨道类型为________ 。
(4)烷烃同系物中,CH4的沸点最低,原因是______________ 。
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为_______________ ;深蓝色晶体中存在的化学键类型有__________ 。(填代号)
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
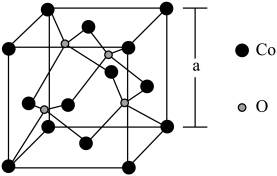
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为______ ;若该晶胞的棱长为a pm,则该晶体的密度为_____________ g/cm3。(NA为阿伏加 德罗常数的值)
(1)P原子的电子排布式为
(2)N、O、F原子的第一电离能由小到大的顺序为
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为
(4)烷烃同系物中,CH4的沸点最低,原因是
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为

您最近一年使用:0次
2020-03-04更新
|
245次组卷
|
3卷引用:内蒙古自治区阿拉善盟2020届高三上学期一模化学试题
9-10高二下·吉林·期末
名校
解题方法
6 . 氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
您最近一年使用:0次
2020-06-16更新
|
796次组卷
|
58卷引用:内蒙古阿拉善左旗高级中学2016-2017学年高二下学期期末考试化学试题
内蒙古阿拉善左旗高级中学2016-2017学年高二下学期期末考试化学试题(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)2010年宁夏青铜峡市高级中学高二下学期期末考试化学试题(已下线)2010年河南省许昌市六校联考高二下学期期末考试化学试题(已下线)2010年江苏省灌南县第二高级中学高二下学期期末考试化学试题(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年四川省树德协进中学高二上学期期中考试化学试卷(已下线)2011-2012学年福建省八县市一中高二下学期期末联考化学试卷(已下线)2011-2012学年辽宁省沈阳二中高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷(已下线)2011-2012学年海南省海南中学高二下学期期末理科化学试卷(已下线)2012-2013学年湖北武汉部分重点中学高二上学期期末考试化学试卷(已下线)2013-2014学年湖北省孝感市七校联考高二下学期期中考试化学试卷(已下线)2013-2014四川省宜昌市部分市级示范高中春季期中考试高二化学试卷(已下线)2015届西藏拉萨中学高三第一次月考化学试卷2015届西藏拉萨中学高三第一次月考化学试卷22014-2015福建省四地六校高二下学期第一次联考化学试卷2014-2015湖北省武汉市部分重点中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2015-2016学年吉林省吉林五十五中高二下3月月考化学试卷2015-2016学年宁夏中卫一中高二下二次月考b卷化学卷2015-2016学年宁夏中卫一中高二下二次月考a卷化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年山西省运城市康杰中学高二上学期测试4化学试卷2015-2016学年福建省漳州市芗城中学高二下期中理科化学试卷2016-2017学年四川省成都市石室佳兴外国语学校高二下学期第一次月考化学试卷2016-2017学年吉林省松原市扶余县第一中学高二下学期第一次月考化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题广西宾阳县宾阳中学2016-2017学年高二下学期7月期末考试化学试题辽宁省实验中学分校2016-2017学年高二6月月考化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质甘肃省嘉峪关市一中2017-2018学年高二上学期期末考试化学(理)试题山东省单县五中2017-2018学年高二下学期第一次月考化学试题甘肃省兰州市第一中学2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题陕西省西安中学2017-2018学年高二(平行班)下学期期末考试化学试题云南省泸水五中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题云南省施甸县县第二完全中学2018-2019学年高二下学期期末考试化学试题广东省梅州市五华县2018-2019学年高二上学期第六次质量监测化学试题山东省泰安市新泰市第二中学2019-2020学年高二下期中考试化学试题陕西省宝鸡中学2019-2020学年高二下学期期中考试化学试题安徽省六安中学2019-2020学年高二下学期期末考试化学试题甘肃省庆阳市镇原中学2019-2020学年高二下学期期末考试化学试题山东省日照第一中学2021届高三上学期10月份第一次调研考试化学试题辽宁省大连市普兰店区第一中学2021届高三第一阶段考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节综合训练陕西省西安中学2020-2021学年高二上学期期末考试化学试题河南省汤阴县五一中学2019-2020学年高二下学期期中考试化学试题福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题(已下线)2.2.3 分子的空间结构及中心原子杂化轨道类型的判断方法-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期期中考试化学试题四川省平昌县得胜中学2021-2022学年高二上学期10月月考化学试题四川省宜宾市叙州区第一中学校2022-2023学年高二上学期第一学月考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期6月阶段性测试化学试题
2016高二·全国·课时练习
名校
7 . 能正确表示CH4中碳原子成键方式的电子排布图为
A.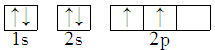 | B.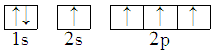 |
C.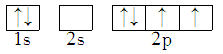 | D.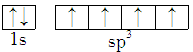 |
您最近一年使用:0次
2018-07-25更新
|
215次组卷
|
6卷引用:内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题
8 . 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
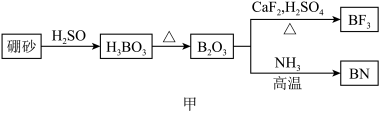
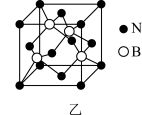
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________ 、__________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的建角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF,BF 的立体结构为
的立体结构为_______ ;
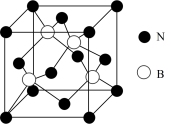
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g· (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。


请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的建角是
 的立体结构为
的立体结构为(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
您最近一年使用:0次
2019-01-30更新
|
2640次组卷
|
14卷引用:内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题
内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题2011年普通高等学校招生全国统一考试化学卷(新课标)(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年河南灵宝第三高级中学高二下学期第三次检测化学卷(已下线)2014高考名师推荐化学选做题练习22016届重庆市部分中学高三上学期第一次月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题
名校
9 . 已知元素X、Y、Z、W、R为前四周期元素,且原子序数依次增大。X基态原子核外有三个未成对电子,Z、W分别是短周期中电负性最大和最小的元素;R2+离子的3d轨道中有三对成对电子。请回答下列问题:
(1)R基态原子的电子排布式为__________ ,元素X、Y、Z的第一电离能由大到小的顺序为(用元素符号表示)___________________ 。
(2)化合物XZ3的空间构型为______ ,R2+与NH3形成的配离子中,提供孤对电子的是_____ 。
(3)Z的氢化物由固体变为气态所需克服的微粒间的作用力是________ 。
(4)Z、W、R形成某种化合物的晶胞结构如右图所示,其化学式为___________ 。
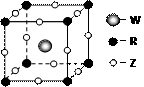
(5)XY2-能被酸性KMnO4溶液氧化,其中MnO4-被还原为Mn2+,反应的离子方程式是________________ 。
(1)R基态原子的电子排布式为
(2)化合物XZ3的空间构型为
(3)Z的氢化物由固体变为气态所需克服的微粒间的作用力是
(4)Z、W、R形成某种化合物的晶胞结构如右图所示,其化学式为

(5)XY2-能被酸性KMnO4溶液氧化,其中MnO4-被还原为Mn2+,反应的离子方程式是
您最近一年使用:0次
2017-11-02更新
|
261次组卷
|
3卷引用:内蒙古阿拉善左旗高级中学 2018届高三10月月考理综化学试题
名校
10 . 膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述不正确的是
| A.PH3分子中有未成键的孤对电子 | B.PH3是极性分子 |
| C.它的分子构型是三角锥形 | D.磷原子采用sp2杂化方式 |
您最近一年使用:0次
2017-07-29更新
|
113次组卷
|
2卷引用:内蒙古阿拉善左旗高级中学2016-2017学年高二下学期期末考试化学试题



