1 . 氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),已知其中一种化合物的化学式为KCuCl3,下列有关说法中错误的是( )
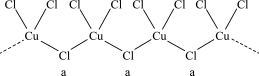

| A.a位置上Cl原子的杂化轨道类型为sp3 |
| B.另一种的化学式为K2CuCl3 |
| C.铜元素在周期表中位于d区 |
| D.该物质中存在配位键 |
您最近一年使用:0次
名校
2 . 液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
| A.NH3分子中氮原子的杂化方式为sp3杂化 |
| B.[Cu(NH3)4]2+中,NH3分子是配体 |
C.NH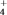 与PH 与PH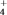 、CH4、BH 、CH4、BH 互为等电子体 互为等电子体 |
| D.相同压强下,NH3的沸点比PH3的沸点低 |
您最近一年使用:0次
名校
3 . 已知H2O2分子的空间结构可在二面角中如图所示,下列有关H2O2结构的说法正确的是( )
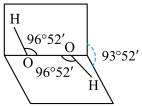
| A.H2O2中有3个σ键、1个π键 |
| B.H2O2为非极性分子 |
| C.H2O2中氧原子为sp杂化 |
| D.H2O2沸点高达158 ℃,可推测H2O2分子间可形成氢键 |
您最近一年使用:0次
2019-04-21更新
|
648次组卷
|
12卷引用:【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题
【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题天津市静海区第一中学2019-2020学年高二下学期3月学生学业能力调研考试化学试题河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题福建省莆田第一中学2019-2020学年高二下学期期中考试化学试题江苏省常熟市2019-2020学年高二下学期期中考试化学试题四川省遂宁市安居区2020-2021学年高二上学期期中考试化学试题四川省遂宁市第二中学2020-2021学年高二上学期期中考试化学试题湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题第三节 分子结构与物质的性质 第2课时 分子间作用力 分子的手性云南省昆明市官渡区尚品书院学校2022-2023学年高二下学期3月月考化学试题四川省成都高新实验中学2023-2024学年高二下学期3月月考化学试卷
名校
4 . 化合物NH3与BF3可以通过配位键形成NH3·BF3,下列说法正确的是( )
| A.NH3与BF3都是三角锥形 | B.NH3与BF3都是极性分子 |
| C.NH3·BF3中各原子都达到8电子稳定结构 | D.NH3·BF3中,NH3提供孤电子对,BF3提供空轨道 |
您最近一年使用:0次
2019-04-21更新
|
757次组卷
|
14卷引用:【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题
【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题福建省永春县第一中学2018-2019学年高二下学期期中考试化学试题沪科版高中化学拓展课程第2章《化学键与晶体结构》检测题四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省福州第一中学2019-2020学年高二下学期期末考试化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题2021年山东高考化学试题变式题1-10山西省太原市英才学校2022-2023学年高二下学期3月阶段测试化学试题四川省广元市苍溪中学校2022-2023学年高二下学期5月期中考试化学试题2.3离子键、配位键与金属键(课前)-鲁科版选择性必修2湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . 二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰(CH3COO)3Mn]可用于制造离子电池的负极材料。合成方程式如下:
2H2C2O4+SiC14+2LiBF4==2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40 CH3COOH
(1)基态Mn原子的核外电子排布式为_________ 。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是___________ ,1mol草酸分子中含有 键的数目为
键的数目为_______________ 。
(3)与SiF4互为等电子体的两种阴离子的化学式为_________________ 。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为___________________ 。
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是_______________ 。

(6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为___________ ,若硼氢化钠晶体的密度为d g/cm3,NA表示阿伏伽德罗常数的值,则a=______ (用含d、NA的代数式表示);若硼氢化钠晶胞上、下底心处的Na+被Li+取代,则得到晶体的化学式为___________________ 。
2H2C2O4+SiC14+2LiBF4==2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40 CH3COOH
(1)基态Mn原子的核外电子排布式为
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
 键的数目为
键的数目为(3)与SiF4互为等电子体的两种阴离子的化学式为
(4)CH3COOH易溶于水,除了它是极性分子外,还因为
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是

(6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为
您最近一年使用:0次
2019-04-08更新
|
567次组卷
|
3卷引用:【市级联考】山东省聊城市2019届高三下学期3月份一模考试理科综合化学试题
名校
6 . 下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )


| A.32 g S8分子中含有0.125 mol σ键 |
| B.SF6是由极性键构成的分子 |
| C.1 mol C2H2分子中有3 mol σ键和2 mol π键 |
| D.S8中S的杂化方式为sp3杂化 |
您最近一年使用:0次
2019-04-08更新
|
218次组卷
|
3卷引用:内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题
2019高二下·全国·专题练习
名校
7 . 下列分子中的立体结构模型正确的是
A.CO2的立体结构模型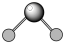 | B.H2O的立体结构模型 |
C.NH3的立体结构模型 | D.CH4的立体结构模型 |
您最近一年使用:0次
2019-03-10更新
|
709次组卷
|
7卷引用:内蒙古包头市第四中学2018-2019学年高二下学期第一次月考(3月)化学试题
内蒙古包头市第四中学2018-2019学年高二下学期第一次月考(3月)化学试题(已下线)2019年3月10日 《每日一题》人教选修3-每周一测2020届人教版高中化学高三专题基础复习专题12《物质结构与性质》测试卷(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构 第1课时 分子结构(已下线)模块同步卷06 阶段性检测卷-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)新疆额敏县第二中学2021-2022学年高二下学期期中考试化学试题2.2.1 分子结构的测定和多样性 价层电子对互斥模型-随堂练习
8 . 第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________ ,TiCl4沸点136℃,熔点-25℃,晶体类型为___________ 晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________ 。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________ ;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________ ,理由是______________________ 。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________ 堆积;该晶胞中原子的体积占晶胞体积的百分率为___________ 。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏伽德罗常数的值,则钴原子半径为___________ mm,钴的相对原子质量可表示为___________ 。
(1)钛原子的价电子排布式为
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏伽德罗常数的值,则钴原子半径为
您最近一年使用:0次
2019-02-05更新
|
600次组卷
|
2卷引用:内蒙古开鲁县第一中学2019-2020学年高二下学期期中考试化学试题
9-10高二下·黑龙江·期末
名校
解题方法
9 . 下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
| A.丙烯分子有8个σ键,1个π键 | B.丙烯分子中3个碳原子都是sp3杂化 |
| C.丙烯分子存在非极性键 | D.丙烯分子中3个碳原子在同一平面上 |
您最近一年使用:0次
2019-01-30更新
|
588次组卷
|
12卷引用:内蒙古通辽市2019-2020学年高二下学期期中考试化学试题
内蒙古通辽市2019-2020学年高二下学期期中考试化学试题(已下线)09—10年哈三中高二下学期期末考试化学卷(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷(已下线)2011-2012学年四川省雅安中学高二12月月考化学试卷(已下线)2011-2012学年湖北省襄阳市高二下学期四校联考期中考试化学试卷(已下线)2012-2013学年湖北省孝感高级中学高二上学期期末考试化学试卷辽宁省部分重点高中2020-2021学年高二下学期期中考试化学试题(已下线)专题17 烃-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省大庆市东风中学2021-2022学年高二下学期期末考试化学试题福建省上杭县第五中学、才溪中学2020-2021学年高二下学期期中联考化学试题
10 . 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
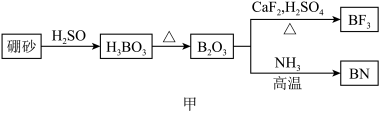
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________ 、__________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的建角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF,BF 的立体结构为
的立体结构为_______ ;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
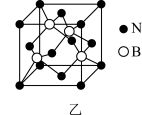
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g· (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。


请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的建角是
 的立体结构为
的立体结构为(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
您最近一年使用:0次
2019-01-30更新
|
2642次组卷
|
14卷引用:内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题
内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题2011年普通高等学校招生全国统一考试化学卷(新课标)(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年河南灵宝第三高级中学高二下学期第三次检测化学卷(已下线)2014高考名师推荐化学选做题练习22016届重庆市部分中学高三上学期第一次月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题



