9-10高二下·黑龙江·期末
名校
解题方法
1 . 下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
| A.丙烯分子有8个σ键,1个π键 | B.丙烯分子中3个碳原子都是sp3杂化 |
| C.丙烯分子存在非极性键 | D.丙烯分子中3个碳原子在同一平面上 |
您最近一年使用:0次
2019-01-30更新
|
601次组卷
|
13卷引用:内蒙古通辽市2019-2020学年高二下学期期中考试化学试题
内蒙古通辽市2019-2020学年高二下学期期中考试化学试题(已下线)09—10年哈三中高二下学期期末考试化学卷(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷(已下线)2011-2012学年四川省雅安中学高二12月月考化学试卷(已下线)2011-2012学年湖北省襄阳市高二下学期四校联考期中考试化学试卷(已下线)2012-2013学年湖北省孝感高级中学高二上学期期末考试化学试卷辽宁省部分重点高中2020-2021学年高二下学期期中考试化学试题(已下线)专题17 烃-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省大庆市东风中学2021-2022学年高二下学期期末考试化学试题福建省上杭县第五中学、才溪中学2020-2021学年高二下学期期中联考化学试题黑龙江省大庆市第二中学2023-2024学年高二下学期期末检测化学试卷
2 . 氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
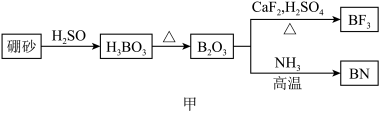
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________ 、__________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的建角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF,BF 的立体结构为
的立体结构为_______ ;
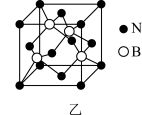
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______ 各氮原子、________ 各硼原子,立方氮化硼的密度是_______ g· (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。


请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的建角是
 的立体结构为
的立体结构为(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
您最近一年使用:0次
2019-01-30更新
|
2695次组卷
|
14卷引用:内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题
内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题2011年普通高等学校招生全国统一考试化学卷(新课标)(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年河南灵宝第三高级中学高二下学期第三次检测化学卷(已下线)2014高考名师推荐化学选做题练习22016届重庆市部分中学高三上学期第一次月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题
3 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中C原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为______ 和______ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为______ 。
(4)化合物D2A的立体构型为___ ,中心原子的价层电子对数为______ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________ 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______ :晶胞中A原子的配位数为_________ ;列式计算晶体F的密度(g.cm-3)_____ 。
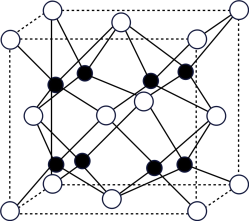
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为

您最近一年使用:0次
2019-01-30更新
|
7162次组卷
|
32卷引用:2015年全国普通高等学校招生统一考试化学(新课标II卷)
2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届广东省仲元中学高三11月月考理科综合化学试卷2016届重庆市第一中学高三上12月月考理综化学试卷2016届宁夏六盘山中学高三上第一次模拟理综化学试卷2017届江西省九江市十校高三第二次联考理科综合化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题河北省正定中学2017届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷山西省应县第一中学校2018-2019学年高二下学期期中考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题广东省深圳外国语学校2021届高三上学期11月月考化学试题四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题(已下线)2020年海南卷化学高考真题变式题15-19内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷广东省2021届高三“六校联盟”第三次联考化学试题四川省成都龙泉中学2021届高三下学期4月月考理科综合化学试题吉林省松原市实验高级中学2021届高三5月月考化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题
名校
4 . 硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________ ,第四电离能I4(Co) < I4(Fe),其原因是______________________________ ;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是___________________________________________________ .
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______ ,中心原子杂化方式是_______ ,与其互为等电子体的分子是_______ (举1例)。
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是___________________________________________________________________ 。
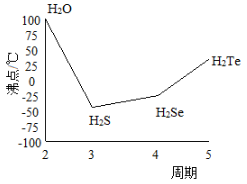
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图象所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。
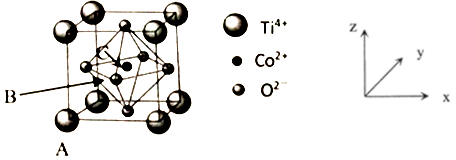
①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为_____ 。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____ g/cm3(列出计算表达式即可)。
(1)基态Co原子价电子轨道排布式为
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图象所示变为的原因是

(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为
②已知晶胞参数为a=0.5485nm,则该晶体的密度为
您最近一年使用:0次
2018-12-19更新
|
208次组卷
|
2卷引用:【全国百强校】内蒙古第一机械制造(集团)有限公司第一中学2019届高三上学期12月月考理科综合化学试题
2018高三上·全国·专题练习
名校
5 . 下列物质中,化学键类型和分子空间构型皆相同的是
| A.CO2和SO3 | B.CH4和SiH4 | C.BF3和PH3 | D.HCl和NH4Cl |
您最近一年使用:0次
2018-12-03更新
|
258次组卷
|
6卷引用:2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式
(已下线)2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式新疆乌鲁木齐市第四中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年11月27日 《每日一题》2020年高考化学一轮复习——分子(或离子)构型与中心原子的杂化方式内蒙古自治区第二地质中学2023-2024学年高二下学期4月月考化学试题新疆哈密市第八中学2021-2022学年高二下学期期中考试化学试题广东省北京师范大学珠海分校附属外国语学校2021-2022学年高二3月阶段性验收化学试题
名校
解题方法
6 . 下列分子或离子中键角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
| A.⑤④①②③ | B.④①②⑤③ | C.⑤①④②③ | D.③②④①⑤ |
您最近一年使用:0次
2018-10-11更新
|
517次组卷
|
16卷引用:宁夏石嘴山市第三中学2018届高三9月月考化学试题
宁夏石嘴山市第三中学2018届高三9月月考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题【全国百强校】福建省厦门外国语学校2018-2019学年高二上学期第一次月考化学试题河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题【全国百强校】福建省厦门第一中学2018-2019学年高二上学期期中考试化学试题(已下线)【全国百强校】吉林省延边第二中学2018-2019学年高二下学期期中考试化学试题内蒙古自治区科尔沁左翼中旗实验高级中学2023-2024学年高三上学期11月月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构甘肃省高台县第一中学2021-2022学年高二下学期3月月考化学试题山东省青岛第五十八中学2022-2023学年高二上学期期末考试化学试题江西省宜春市丰城市第九中学日新班2023-2024学年高二上学期期末考试化学试题山西省太原师范学院附属中学 师苑中学校2023-2024学年高二下学期准高三第二次月考化学试题贵州省黔西南州金成实验学校2023-2024学年高二下学期3月月考化学试题(已下线)第03讲 分子结构与性质、化学键(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
7 . 在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中的共价键类型是
| A.仅有σ键 | B.三个σ键,两个π键 |
| C.两个σ键,两个π键 | D.三个σ键,一个π键 |
您最近一年使用:0次
2018-09-01更新
|
407次组卷
|
7卷引用:辽宁省实验中学2017-2018学年高二下学期期中考试理科化学试题
名校
解题方法
8 . 下列中心原子的杂化轨道类型和分子几何构型不正确的是
| A.PCl3中P原子sp3杂化,为三角锥形 |
| B.NH4+中N原子sp3杂化,为正四面体形 |
| C.H2S中S原子sp杂化,为直线形 |
| D.SO2中S原子sp2杂化,为V形 |
您最近一年使用:0次
2018-07-30更新
|
1562次组卷
|
7卷引用:福建省莆田第六中学2017-2018学年高二6月月考化学试题B
2016高二·全国·课时练习
名校
9 . 能正确表示CH4中碳原子成键方式的电子排布图为
A.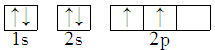 | B.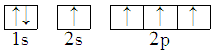 |
C.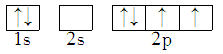 | D.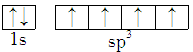 |
您最近一年使用:0次
2018-07-25更新
|
215次组卷
|
6卷引用:内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题
2010·陕西·一模
10 . 石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是________ 。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为________ 。
②乙醇沸点比氯乙烷高,主要原因是_______________________ 。
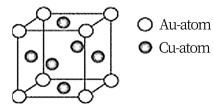
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:________ 。
④含碳原子且属于非极性分子的是________ ;
a.甲烷 b.乙炔 c.苯 d.乙醇
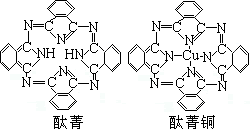
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________ 。

(1)下列有关石墨烯说法正确的是
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为
②乙醇沸点比氯乙烷高,主要原因是
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:

④含碳原子且属于非极性分子的是
a.甲烷 b.乙炔 c.苯 d.乙醇
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:

您最近一年使用:0次
2018-07-17更新
|
134次组卷
|
3卷引用:【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题(已下线)2010年陕西省五校高三第一次模拟考试理综化学试题山东省济南市高新区新2019-2020学年高三化学一轮复习《物质结构与性质》专题测试



