解题方法
1 . 某小组同学探究实验室配制银氨溶液并检验醛基的方法。
资料:i.AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的 。
。
ii.向硝酸银溶液中加入氨水,转化为 的
的 占参加反应的
占参加反应的 总量的百分比最大不超过10%。
总量的百分比最大不超过10%。
Ⅰ.在实验室配制银氨溶液的过程中,小组同学发现,所用试剂的配制方式和存放时间不同,实验现象不同。(注:以下试剂若无特殊说明,均为新制)
(1)NH3分子空间构型为_______ 。
(2)结合资料ii,写出实验1中加入少量氨水时发生的主要反应的离子方程式_______ 。
(3)已知,实验2中白色沉淀加硝酸产生能使澄清石灰水变浑浊的无色气体,实验2中白色沉淀的主要成分是_______ 。
(4)对比实验1和3,分析实验3中“溶液始终澄清”的原因是_______ 。
Ⅱ.用实验1配制出的银氨溶液检验醛基。
资料:可从电极反应角度分析物质氧化性和还原性的变化。
(5)银氨溶液与CH3CHO的反应中,电极反应式:
还原反应:Ag++e-=Ag;氧化反应:_______ (碱性条件下)。
在此基础上设计并实施了以下实验。
(6)实验5产生银镜比实验4快的可能原因是_______ 。按照实验5的方法,将乙醛换成丙酮,水浴加热后也能产生银镜。
综合上述实验,实验4是检验醛基的最合理方法。
资料:i.AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的
 。
。ii.向硝酸银溶液中加入氨水,转化为
 的
的 占参加反应的
占参加反应的 总量的百分比最大不超过10%。
总量的百分比最大不超过10%。Ⅰ.在实验室配制银氨溶液的过程中,小组同学发现,所用试剂的配制方式和存放时间不同,实验现象不同。(注:以下试剂若无特殊说明,均为新制)
| 序号 | 实验操作 | 实验现象 |
| 1 | 向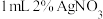 溶液中逐滴加入2%氨水 溶液中逐滴加入2%氨水 | 先产生棕色沉淀,后溶液变澄清 |
| 2 | 向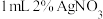 溶液中逐滴加入在空气中存放一段时间的2%氨水 溶液中逐滴加入在空气中存放一段时间的2%氨水 | 先产生白色沉淀,后溶液变澄清 |
| 3 | 向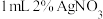 ( ( 酸化)溶液中逐滴加入2%氨水至过量 酸化)溶液中逐滴加入2%氨水至过量 | 溶液始终澄清 |
(2)结合资料ii,写出实验1中加入少量氨水时发生的主要反应的离子方程式
(3)已知,实验2中白色沉淀加硝酸产生能使澄清石灰水变浑浊的无色气体,实验2中白色沉淀的主要成分是
(4)对比实验1和3,分析实验3中“溶液始终澄清”的原因是
Ⅱ.用实验1配制出的银氨溶液检验醛基。
资料:可从电极反应角度分析物质氧化性和还原性的变化。
(5)银氨溶液与CH3CHO的反应中,电极反应式:
还原反应:Ag++e-=Ag;氧化反应:
在此基础上设计并实施了以下实验。
| 序号 | 实验操作 | 实验现象 |
| 4 | 向银氨溶液中加入3滴 ,水浴加热 ,水浴加热 | 产生银镜 |
| 5 | 向银氨溶液中加入1滴10% NaOH溶液后,滴入3滴 | 产生银镜比实验4快 |
综合上述实验,实验4是检验醛基的最合理方法。
您最近一年使用:0次
2 . 水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。
(1) 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于___________ 。
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.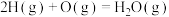 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量___________ ;②反应速率___________ 。
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为: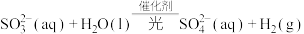 。
。
(3)已知 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为___________ 。
A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
(5) 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中 的操作方法:
的操作方法:________ 。
“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
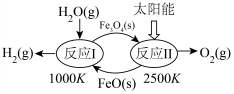
(7)写出反应I的化学方程式:___________ ;若该反应生成标准状况下 氢气,转移电子数目为
氢气,转移电子数目为___________ 。
(8)科学家想要用组成相似的钴氧化物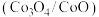 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
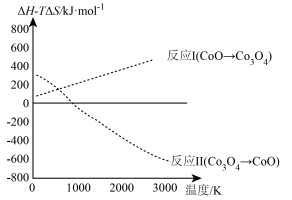
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由___________ 。
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:___________ (简述即可,不必展开)。
 分解为
分解为 和
和 ;若温度进一步升高至5000K,
;若温度进一步升高至5000K, 与
与 会分解为气态原子。
会分解为气态原子。(1)
 分解过程中断裂的化学键属于
分解过程中断裂的化学键属于A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
i.
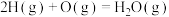 ii.
ii.
比较下列量的相对大小(均从选项中选择):①放出热量
A.i>ii B.i=ii C.i<ii
“太阳能光催化分解水制氢”原理可以表示为:
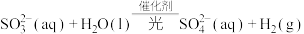 。
。(3)已知
 呈平面正三角形结构,推测
呈平面正三角形结构,推测 的立体构型为
的立体构型为A.平面正三角形 B.正四面体型 C.三角锥型
(4)能说明氯的非金属性比硫强的事实是___________。
A.溶解性: | B.氧化性: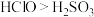 |
C.热稳定性: | D.酸性: |
(5)
 与
与 结构相似,但
结构相似,但 的沸点高于
的沸点高于 ,原因是
,原因是(6)反应开始一段时间后,取出一定量溶液,写出检验溶液中
 的操作方法:
的操作方法:“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生
 。如常见的铁氧化物循环制氢过程如图所示。
。如常见的铁氧化物循环制氢过程如图所示。
(7)写出反应I的化学方程式:
 氢气,转移电子数目为
氢气,转移电子数目为(8)科学家想要用组成相似的钴氧化物
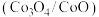 代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的
代替铁氧化物进行循环制氢。查阅资料发现,使用钴氧化物后反应I和反应II的 值随温度
值随温度 变化如图所示。
变化如图所示。
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由
(9)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:
您最近一年使用:0次
3 . 亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
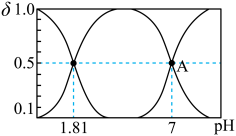
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性,原因是___________ 。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于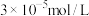 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于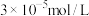 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近一年使用:0次
名校
4 . 锰酸钾( )可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗
)可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗 为原料,制备锰酸钾的反应为:
为原料,制备锰酸钾的反应为: 。下列说法错误的是
。下列说法错误的是
 )可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗
)可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗 为原料,制备锰酸钾的反应为:
为原料,制备锰酸钾的反应为: 。下列说法错误的是
。下列说法错误的是| A.X的化学式是KCl |
B. 阴离子的VSEPR模型为四面体形 阴离子的VSEPR模型为四面体形 |
C. 、 、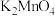 均具有氧化性和还原性 均具有氧化性和还原性 |
| D.生成1molX,转移2mol电子 |
您最近一年使用:0次
2023-05-27更新
|
281次组卷
|
3卷引用:山东省潍坊市2023届高三下学期三模化学试题
5 . 我国硒含量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸(H2SeO3)进而制备单质硒。
(1)工业上在103℃的条件下,用甲酸(HCOOH)还原含亚硒酸(H2SeO3)的工业废液提取硒,此反应的化学方程式为___________ 。
(2)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液也可直接制得单质硒,写出电解时阴极上发生的电极反应___________ 。
(3)基态Se原子电子占据最高能级的电子云轮廓图为___________ 形。 号的空间结构为
号的空间结构为___________ 形。
(4)关于硒单质及其化合物说法正确的是___________ (填标号)。
a.硒单质在常温下呈固态 b. 既有氧化性又有还原性
既有氧化性又有还原性
c.键角: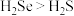 d.
d. 的最高价氧化物对应水化物的化学式为
的最高价氧化物对应水化物的化学式为
(5)室温下, 电离平衡体系中含
电离平衡体系中含 微粒的物质的量分数与溶液
微粒的物质的量分数与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:

 的
的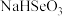 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为___________ ,计算反应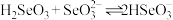 的平衡常数K=
的平衡常数K=___________ 。
(1)工业上在103℃的条件下,用甲酸(HCOOH)还原含亚硒酸(H2SeO3)的工业废液提取硒,此反应的化学方程式为
(2)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液也可直接制得单质硒,写出电解时阴极上发生的电极反应
(3)基态Se原子电子占据最高能级的电子云轮廓图为
 号的空间结构为
号的空间结构为(4)关于硒单质及其化合物说法正确的是
a.硒单质在常温下呈固态 b.
 既有氧化性又有还原性
既有氧化性又有还原性c.键角:
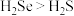 d.
d. 的最高价氧化物对应水化物的化学式为
的最高价氧化物对应水化物的化学式为
(5)室温下,
 电离平衡体系中含
电离平衡体系中含 微粒的物质的量分数与溶液
微粒的物质的量分数与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:
 的
的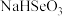 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为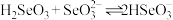 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
6 . 下列有关HNO2和HNO3的说法不 正确的是
| A.HNO2既有氧化性又有还原性 |
| B.HNO3不稳定,受热易分解 |
C. 的空间构型为V形 的空间构型为V形 |
D. 中N原子的杂化方式为sp3 中N原子的杂化方式为sp3 |
您最近一年使用:0次
2022-01-10更新
|
98次组卷
|
2卷引用:江苏省扬州市江都区大桥高级中学2021-2022学年高三上学期开学检测(二)化学试题
7 . CO2分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用CO2作为碳源,通过CO2催化加氢方式,不仅可以减少温室气体的排放,还可以将CO2转化为高附加值的化学产品,具有重要的战略意义。
(1)若活化CO2,通常需要采取适当的方式使CO2的分子结构从_______ (填分子的空间结构名称)变为弯曲型,便于下一步反应。
(2)一种CO2直接加氢的反应机理如图a所示。

①写出总反应的化学方程式_______ 。
②MgOCO2也可以写成MgCO3,写出CO 的VSEPR模型名称
的VSEPR模型名称_______ 。
(3)①已知:主反应CO2催化加氢制甲醇是放热反应
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式_______ (ΔH用含ΔH1和ΔH2的代数式表示)。
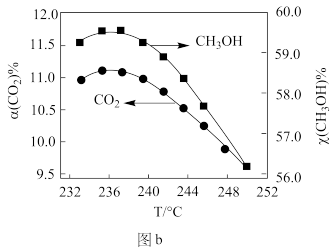
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=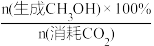 ]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因_______ 。
③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式_______ 。
(1)若活化CO2,通常需要采取适当的方式使CO2的分子结构从
(2)一种CO2直接加氢的反应机理如图a所示。

①写出总反应的化学方程式
②MgOCO2也可以写成MgCO3,写出CO
 的VSEPR模型名称
的VSEPR模型名称(3)①已知:主反应CO2催化加氢制甲醇是放热反应
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=
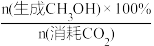 ]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因
③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式
您最近一年使用:0次
真题
解题方法
8 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: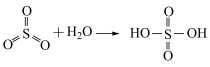
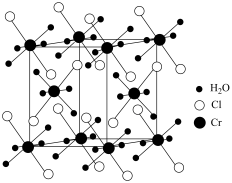
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: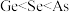 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
解题方法
9 . 含氮化合物在生活中占有重要地位。请回答:
(1) 可通过配位键与
可通过配位键与 形成
形成 。形成该配合物时,基态
。形成该配合物时,基态 的价层电子发生重排提供两个空轨道,则重排后的
的价层电子发生重排提供两个空轨道,则重排后的 价电子排布图为
价电子排布图为___________ ; 的金属配合物也已经制备成功,但为数不多,如[
的金属配合物也已经制备成功,但为数不多,如[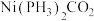 ],已知该配合物的配位数与[
],已知该配合物的配位数与[ ]的配位数相同,测得其中存在两种碳氧键的键长,一个为0.117mm,另一个为0.122nm。请画出[
]的配位数相同,测得其中存在两种碳氧键的键长,一个为0.117mm,另一个为0.122nm。请画出[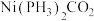 ]的结构示意图:
]的结构示意图:___________ 。
(2) 和
和 是常见含氮化合物,其VSEPR构型均为
是常见含氮化合物,其VSEPR构型均为___________ ,其中二者相比较,键角更大的是___________ 。
(3)N、P、As同属于ⅤA族,下列说法正确的是___________ 。
(4)已知 晶胞结构如图2所示,M处的
晶胞结构如图2所示,M处的 (其位于四个
(其位于四个 所构成的正四面体中心)有一定的朝向,不能随意转动,请解释其原因
所构成的正四面体中心)有一定的朝向,不能随意转动,请解释其原因___________ ,该晶胞的晶胞参数如图所示,设 为阿伏伽德罗常数的值,该晶体的密度ρ=
为阿伏伽德罗常数的值,该晶体的密度ρ=___________  (列出计算式即可)
(列出计算式即可)
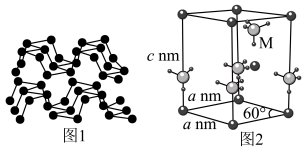
(1)
 可通过配位键与
可通过配位键与 形成
形成 。形成该配合物时,基态
。形成该配合物时,基态 的价层电子发生重排提供两个空轨道,则重排后的
的价层电子发生重排提供两个空轨道,则重排后的 价电子排布图为
价电子排布图为 的金属配合物也已经制备成功,但为数不多,如[
的金属配合物也已经制备成功,但为数不多,如[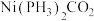 ],已知该配合物的配位数与[
],已知该配合物的配位数与[ ]的配位数相同,测得其中存在两种碳氧键的键长,一个为0.117mm,另一个为0.122nm。请画出[
]的配位数相同,测得其中存在两种碳氧键的键长,一个为0.117mm,另一个为0.122nm。请画出[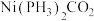 ]的结构示意图:
]的结构示意图:(2)
 和
和 是常见含氮化合物,其VSEPR构型均为
是常见含氮化合物,其VSEPR构型均为(3)N、P、As同属于ⅤA族,下列说法正确的是
| A.原子半径:r(N) >r(P) >r(As)且电负性:N>P>As |
| B.N、P、As的最高价氧化物水化物的酸性依次减弱 |
C.简单氢化物的还原性: |
| D.黑砷和黑磷的结构相似(如图1),每个砷原子最外层均形成8电子结构。其晶体单层中,As原子与As—As键的个数比为2∶3 |
 晶胞结构如图2所示,M处的
晶胞结构如图2所示,M处的 (其位于四个
(其位于四个 所构成的正四面体中心)有一定的朝向,不能随意转动,请解释其原因
所构成的正四面体中心)有一定的朝向,不能随意转动,请解释其原因 为阿伏伽德罗常数的值,该晶体的密度ρ=
为阿伏伽德罗常数的值,该晶体的密度ρ= (列出计算式即可)
(列出计算式即可)
您最近一年使用:0次
名校
10 . 下列有关Cl-、ClO-、ClO 、ClO
、ClO 和ClO
和ClO 的说法
的说法不正确 的是
 、ClO
、ClO 和ClO
和ClO 的说法
的说法A.随Cl元素化合价升高,Cl-、ClO-、ClO 、ClO 、ClO 和ClO 和ClO 的氧化性增强 的氧化性增强 |
B.ClO 、ClO 、ClO 和ClO 和ClO 中心原子轨道的杂化类型均为sp3 中心原子轨道的杂化类型均为sp3 |
C.Cl-可提供孤电子对与CuCl形成CuCl |
D.ClO 的空间构型为三角锥形 的空间构型为三角锥形 |
您最近一年使用:0次



