名校
解题方法
1 . 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子最高能层的电子排布式为
原子最高能层的电子排布式为___________ 。
(2) 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。
(3) 与
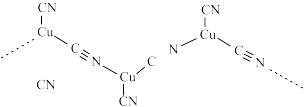
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为___________ 。
(4)铜能与拟卤素 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸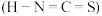 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为___________ ;写出一种与 互为等电子体的分子式
互为等电子体的分子式___________ 。
(5) 可形成
可形成 ,其中
,其中 代表
代表 。
。
①该化合物分子中, 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有___________ 个。
②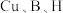 的电负性由大到小的顺序为
的电负性由大到小的顺序为___________ 。
(6)一种由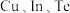 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
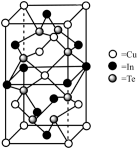
① 的配位数为
的配位数为___________ ;晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为___________ 。
②若晶胞底边的边长均为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态
 原子最高能层的电子排布式为
原子最高能层的电子排布式为(2)
 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。A. | B. | C. | D. |
 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为
(4)铜能与拟卤素
 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为 互为等电子体的分子式
互为等电子体的分子式(5)
 可形成
可形成 ,其中
,其中 代表
代表 。
。①该化合物分子中,
 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有②
 的电负性由大到小的顺序为
的电负性由大到小的顺序为(6)一种由
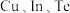 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
①
 的配位数为
的配位数为 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为②若晶胞底边的边长均为
 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-12-03更新
|
997次组卷
|
5卷引用:河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题
河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题河北省石家庄市2022届高三上学期教学质量检测(一)化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】20(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)广东省佛山市李兆基中学、郑裕彤中学两校2021-2022学年高三下学期3月联考化学试题
解题方法
2 . 钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:
(1)基态Ti2+的价电子排布图___________ 。与钛同周期的过渡元素中,基态原子未成对电子数最多的元素为___________ (写元素名称)。
(2)与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较小的是___________ (写元素符号),原因是___________ 。
(3)四乙醇钛Ti(OCH2CH3)4能增加橡胶在金属表面的黏附性,该物质可溶于有机溶剂,常温下为淡黄色透明液体,其固体的晶体类型为___________ ;该物质中非金属元素的电负性从大到小的顺序___________ 。
(4)钛的氯化物TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为___________ 。
(5)钙钛矿CaTiO3有两种构型(A型和B型)。
①其中A型的晶胞如图所示,晶胞边长为a nm,CaTiO3的相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________ g.cm-3。
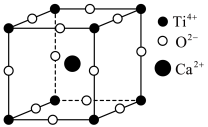
②如果将晶胞原点移到Ca2+上,就是CaTiO3的B型结构。请在虚线框内图示画出B型晶胞的结构图。(注意请用黑色签字笔作图)___________
(1)基态Ti2+的价电子排布图
(2)与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较小的是
(3)四乙醇钛Ti(OCH2CH3)4能增加橡胶在金属表面的黏附性,该物质可溶于有机溶剂,常温下为淡黄色透明液体,其固体的晶体类型为
(4)钛的氯化物TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为
(5)钙钛矿CaTiO3有两种构型(A型和B型)。
①其中A型的晶胞如图所示,晶胞边长为a nm,CaTiO3的相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为

②如果将晶胞原点移到Ca2+上,就是CaTiO3的B型结构。请在虚线框内图示画出B型晶胞的结构图。(注意请用黑色签字笔作图)

您最近一年使用:0次
3 . SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是
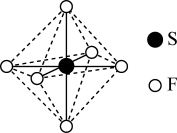
| A.是非极性分子 | B.键角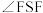 都等于90° 都等于90° |
C. 与 与 之间共用电子对偏向S 之间共用电子对偏向S | D. 原子满足8电子稳定结构 原子满足8电子稳定结构 |
您最近一年使用:0次
2021-10-23更新
|
8195次组卷
|
31卷引用:2021年海南高考化学试题变式题1-10
2021年海南高考化学试题变式题1-10辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题2021年新高考海南化学高考真题辽宁省大石桥市第三高级中学2021-2022学年高三12月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省厦门市第一中学2021-2022学年高二下学期3月适应性练习化学试题(已下线)秘籍03 化学用语-备战2022年高考化学抢分秘籍(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题50 分子的立体结构的判断-备战2023年高考化学一轮复习考点微专题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)第30讲 分子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)巩固训练7(已下线)题型91 分子的极性与共价键的极性判断浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)第21讲分子结构与性质(已下线)第4讲 空间构型(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海中学东校2023-2024学年高三上学期9月月考化学试题海南省文昌中学2023-2024学年高二下学期第一次月考化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题
名校
解题方法
4 . 镍能形成多种配合物如正四面体形的 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的是
等。下列说法不正确的是
 、正方形的
、正方形的 和正八面体形的
和正八面体形的 等。下列说法不正确的是
等。下列说法不正确的是A. 分子内σ键和π键个数之比为1:2 分子内σ键和π键个数之比为1:2 |
B. 的空间结构为三角锥形 的空间结构为三角锥形 |
C. 在形成配合物时,其配位数只能为4 在形成配合物时,其配位数只能为4 |
D. 中,镍元素是 中,镍元素是 杂化 杂化 |
您最近一年使用:0次
2021-09-29更新
|
567次组卷
|
4卷引用:2021年山东高考化学试题变式题1-10
2021年山东高考化学试题变式题1-10河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题(已下线)2020年天津卷化学高考真题变式题1-12(已下线)第3.4讲 配合物与超分子-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
5 . 下列关于物质结构的说法错误的是
| A.铝晶体中微粒间的作用力没有方向性和饱和性 |
B.CH4和 都是正四面体结构,键角均为109°28' 都是正四面体结构,键角均为109°28' |
C.氨基氰(NH2CN)分子内 键与 键与 键数目之比为2:1 键数目之比为2:1 |
| D.甲醛(HCHO)的键角约为120°,分子之间存在氢键 |
您最近一年使用:0次
2021-09-29更新
|
322次组卷
|
8卷引用:山东省泰安市2021届高考第二次模拟化学试题
山东省泰安市2021届高考第二次模拟化学试题山东省泰安第一中学2021届高三二轮检测化学试题安徽省宿州市十三所重点中学2020-2021学年高二下学期期中质量检测化学试题山东省新泰市第一中学东校2020-2021学年高二下学期期中考试化学试题 (已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)卷01 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)山东省济南市山东省实验中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
6 . 硼氢化钠(NaBH4)既是一种重要的储氢材料,又是具有广泛应用的还原剂。NaBH4在水溶液中的稳定性随着溶液pH升高而增大。在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉,反应的离子方程式为2BH +Fe2++6H2O=Fe↓+2B(OH)3+7H2↑,NaBH4-H2O2燃料电池有望成为低温环境下工作的便携式燃料电池。关于NaBH4与FeCl2反应制备纳米铁粉的实验,下列说法正确的是
+Fe2++6H2O=Fe↓+2B(OH)3+7H2↑,NaBH4-H2O2燃料电池有望成为低温环境下工作的便携式燃料电池。关于NaBH4与FeCl2反应制备纳米铁粉的实验,下列说法正确的是
 +Fe2++6H2O=Fe↓+2B(OH)3+7H2↑,NaBH4-H2O2燃料电池有望成为低温环境下工作的便携式燃料电池。关于NaBH4与FeCl2反应制备纳米铁粉的实验,下列说法正确的是
+Fe2++6H2O=Fe↓+2B(OH)3+7H2↑,NaBH4-H2O2燃料电池有望成为低温环境下工作的便携式燃料电池。关于NaBH4与FeCl2反应制备纳米铁粉的实验,下列说法正确的是| A.反应中Fe2+和H2O都是氧化剂 | B.Fe2+转化为Fe得到的2个电子基态时填充在3d轨道上 |
C.BH 具有正方形构型 具有正方形构型 | D.降低反应液的pH有利于提高纳米铁粉的产率 |
您最近一年使用:0次
2021-09-28更新
|
377次组卷
|
8卷引用:江苏省2021届高三第二次适应性考试化学试卷
名校
解题方法
7 . 单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1). 基态镍原子的核外电子排布式为_______ 。
(2). 氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为_______ ﹔在上述三种物质的分子中碳原子杂化类型不同于其他两种的是_______ ,立体构型为正四面体的分子是_______ ,三种物质中沸点最高的是CH3OH,其原因是_______ 。
(3). Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是_______ ,Ni(CO)4晶体类型是_______ 。
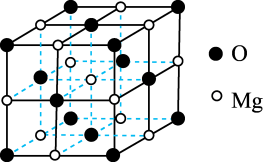
(4). 已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgО晶胞边长为0.42nm,则MgO的密度为_______ g/cm3(保留小数点后一位)。
(1). 基态镍原子的核外电子排布式为
(2). 氧化镁载体及镍催化反应中涉及到CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为
(3). Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是
(4). 已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgО晶胞边长为0.42nm,则MgO的密度为

您最近一年使用:0次
2021-08-06更新
|
378次组卷
|
3卷引用:福建省莆田一中2021届高三模拟质量检测化学试题
福建省莆田一中2021届高三模拟质量检测化学试题(已下线)专题十一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)四川省邻水实验学校2021-2022学年高三上学期第三阶段考试理综化学试题
名校
解题方法
8 . 下列关于元素及化合物的结构和性质的论述正确的是
A. 和 和 中的硫原子均采取 中的硫原子均采取 杂化的方式,都存在 杂化的方式,都存在 |
B.键长 ,因此三种氢化物中水最稳定 ,因此三种氢化物中水最稳定 |
C.碳化硅中 键的键长大于金刚石中 键的键长大于金刚石中 键的键长,因此碳化硅的熔点高于金刚石的熔点 键的键长,因此碳化硅的熔点高于金刚石的熔点 |
D. 的非金属性强于 的非金属性强于 ,因此 ,因此 能与 能与 溶液反应置换出 溶液反应置换出 |
您最近一年使用:0次
2021-07-12更新
|
354次组卷
|
4卷引用:清华大学中学生标准学术能力诊断性测试2022届高三2021年7月诊断性测试化学试题
清华大学中学生标准学术能力诊断性测试2022届高三2021年7月诊断性测试化学试题(已下线)第37讲 分子结构与性质(精练)-2022年一轮复习讲练测(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)新疆石河子第一中学2021-2022学年高二4月月考化学试题
名校
解题方法
9 . 资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2 CH4+2H2O。下列有关CO2、CH4的说法正确的是
CH4+2H2O。下列有关CO2、CH4的说法正确的是
 CH4+2H2O。下列有关CO2、CH4的说法正确的是
CH4+2H2O。下列有关CO2、CH4的说法正确的是| A.CO2的空间构型是V形 |
| B.CH4是极性分子 |
| C.电负性:O>C>H |
| D.CO2转化为CH4体现了CO2的还原性 |
您最近一年使用:0次
2021-07-01更新
|
915次组卷
|
4卷引用:2021年湖北高考化学试题变式题1-10
解题方法
10 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe•3H2O}几乎不溶于乙醇,易被氧化。以赤铁矿渣(主要成分是Fe2O3,含少量Al2O3、SiO2杂质)和乳酸[CH3CH(OH)COOH]为原料制取乳酸亚铁晶体的工艺如图所示:
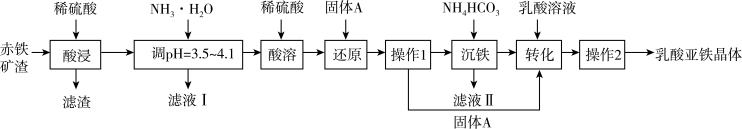
已知:
回答下列问题:
(1)C、N、O的一第电离能由大到小的顺序为___________ ,H2O的中心原子的孤电子对数为___________ 。
(2)常温下,调pH=3.5~4.1的目的是___________ 。
(3)“沉铁”过程的离子方程式为___________ 。
(4)“操作2”具体为:隔绝空气低温蒸发浓缩、___________ 、冷却结晶、过滤、乙醇洗涤、真空干燥,密封储存产品。乙醇洗涤的目的是___________ 。
(5)可用高锰酸钾滴定法测定样品中Fe2+的量,进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________ :经查阅文献后,小组同学改用Ce(SO4)2标准溶液滴定法进行测定。反应中Ce4+的还原产物为Ce3+。测定时称取3.0g样品溶于水,配成100mL溶液,每次取20mL的溶液用0.100mol•L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
则产品中乳酸亚铁晶体的纯度为___________ 。

已知:
| 金属氢氧化物 | 溶度积Ksp | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 2×10-32 | 4.1 | 5.4 |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.4 |
回答下列问题:
(1)C、N、O的一第电离能由大到小的顺序为
(2)常温下,调pH=3.5~4.1的目的是
(3)“沉铁”过程的离子方程式为
(4)“操作2”具体为:隔绝空气低温蒸发浓缩、
(5)可用高锰酸钾滴定法测定样品中Fe2+的量,进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是
| 滴定序号 | 0.100mol•L-1Ce(SO4)2标准溶液体积/mL | |
| 滴定前读数 | 滴定后读数 | |
| 1 | 0.10 | 19.85 |
| 2 | 0.12 | 21.32 |
| 3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
2021-06-15更新
|
782次组卷
|
4卷引用:辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题
辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题2021年湖南省高考化学试卷变式题11-19(已下线)微专题33 化学工艺流程题——物质的分离与提纯-备战2022年高考化学考点微专题(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)



