名校
1 . 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子的核外电子占据3个能级且每个能级上电子数相等,基态C原子价层电子排布式为 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
(1)基态E原子有___________ 种运动状态不同的电子,D位于元素周期表___________ 区。
(2)在A、B、C、D的简单氢化物中,沸点最高的是___________ (填化学式,下同);键角最大的是___________ 。
(3) 分子中D的杂化类型是
分子中D的杂化类型是___________ ;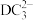 的空间结构为
的空间结构为___________ 。
(4)元素的基态气态原子得到一个电子形成 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:___________ 。
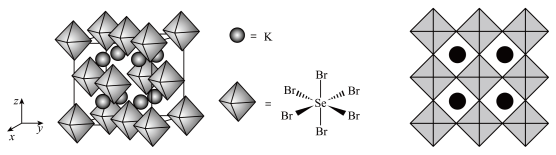
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为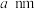 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为___________ ,该晶体密度为___________  。
。
 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:(1)基态E原子有
(2)在A、B、C、D的简单氢化物中,沸点最高的是
(3)
 分子中D的杂化类型是
分子中D的杂化类型是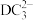 的空间结构为
的空间结构为(4)元素的基态气态原子得到一个电子形成
 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为
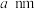 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为 。
。
您最近一年使用:0次
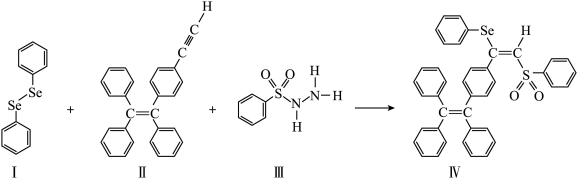
2 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:___________ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是___________ 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有___________ 。
A.Ⅰ中有σ键和π键
B.Ⅰ中的 键为极性共价键
键为极性共价键
C.Ⅱ难溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与
E.Ⅲ含有的元素中,N电负性最大
(4)Ⅳ中具有孤对电子的原子有___________ 。
(5)硒的两种含氧酸的酸性强弱为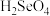
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(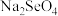 )可减轻重金属铊引起的中毒;
)可减轻重金属铊引起的中毒; 的立体构型为
的立体构型为___________ 。
(6)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示,其中原子坐标参数A为(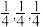 ),则C的原子坐标参数为
),则C的原子坐标参数为___________ 。
(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
A.Ⅰ中有σ键和π键
B.Ⅰ中的
 键为极性共价键
键为极性共价键C.Ⅱ难溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与

E.Ⅲ含有的元素中,N电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为
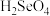
 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(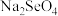 )可减轻重金属铊引起的中毒;
)可减轻重金属铊引起的中毒; 的立体构型为
的立体构型为(6)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示,其中原子坐标参数A为(
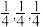 ),则C的原子坐标参数为
),则C的原子坐标参数为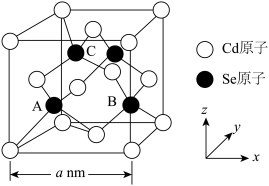
您最近一年使用:0次
名校
解题方法
3 . 金属钛(Ti)被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________ 。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ 。
(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
① 乙二胺中,N原子的杂化方式为___________ ,C、H、N的电负性由大到小的顺序为___________ 。
② 1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
③ 乙二胺形成配合物后,H—N—H键角将变大,原因是___________ 。___________ pm(列出计算式)。
(1)基态Ti原子的价电子轨道表示式为
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)锆(Zr)与钛(Ti)是同一副族的相邻元素,ZrCl4可以与乙二胺(H2NCH2CH2NH2)形成六配位化合物[ZrCl4(H2NCH2CH2NH2)]。
① 乙二胺中,N原子的杂化方式为
② 1mol[ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
③ 乙二胺形成配合物后,H—N—H键角将变大,原因是

您最近一年使用:0次
4 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)电负性P_______ As(填“>”或“<”或“=”)。
(2)尿素(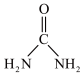 )中碳原子杂化类型
)中碳原子杂化类型_______ ; 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为_______ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是_______ 。
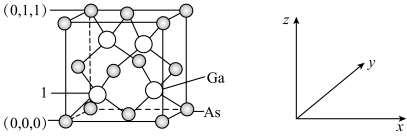
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。_______ ,As与Ga之间存在的化学键有_______ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为_______ 。晶胞密度为dg∙cm-3,摩尔质量为Mg∙mol-1 ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为_______ nm(列式表示)。
(1)电负性P
(2)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为
您最近一年使用:0次
名校
5 . 地壳中含量排在前七位的元素分别是 ,占到地壳总质量的
,占到地壳总质量的 以上。回答下列问题:
以上。回答下列问题:
(1)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中
中 元素采取
元素采取___________ 杂化,其立体构型为___________ (填名称)。
② 中含有的作用力类型有(填序号)
中含有的作用力类型有(填序号)___________ 。
 离子键
离子键 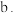 金属键
金属键  极性键
极性键  非极性键
非极性键  配位键
配位键
③ 中
中 元素的化合价为
元素的化合价为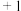 ,则铁的配体为
,则铁的配体为___________ (填化学式)。
(2)硅酸盐中的硅酸根通常以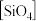 四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式:
四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式:___________ 。 属于
属于 型晶体,
型晶体, 占据由
占据由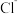 围成的八面体空隙。已知
围成的八面体空隙。已知 和
和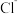 的半径分别为
的半径分别为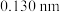 和
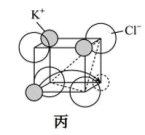
和 ,晶体中阴阳离子紧密相切。若
,晶体中阴阳离子紧密相切。若 晶体产生了阳离子空位(如图丙),请计算
晶体产生了阳离子空位(如图丙),请计算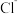 围成的最小窗孔的半径为
围成的最小窗孔的半径为___________ 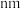 ,则
,则 晶体
晶体___________ (填“能”或“不能”)成为快离子导体。(已知: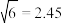 )
)
 ,占到地壳总质量的
,占到地壳总质量的 以上。回答下列问题:
以上。回答下列问题:(1)“棕色环”现象是检验溶液中
 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入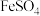 、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
、随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中
中 元素采取
元素采取②
 中含有的作用力类型有(填序号)
中含有的作用力类型有(填序号)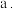 离子键
离子键 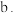 金属键
金属键  极性键
极性键  非极性键
非极性键  配位键
配位键③
 中
中 元素的化合价为
元素的化合价为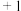 ,则铁的配体为
,则铁的配体为(2)硅酸盐中的硅酸根通常以
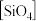 四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式:
四面体(如图甲)的方式形成链状、环状或网络状复杂阴离子。图乙为一种环状硅酸根离子,写出其化学式: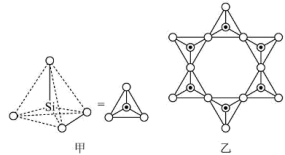
 属于
属于 型晶体,
型晶体, 占据由
占据由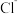 围成的八面体空隙。已知
围成的八面体空隙。已知 和
和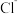 的半径分别为
的半径分别为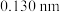 和
和 ,晶体中阴阳离子紧密相切。若
,晶体中阴阳离子紧密相切。若 晶体产生了阳离子空位(如图丙),请计算
晶体产生了阳离子空位(如图丙),请计算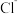 围成的最小窗孔的半径为
围成的最小窗孔的半径为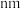 ,则
,则 晶体
晶体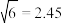 )
)
您最近一年使用:0次
名校
6 . 下列有关结构和性质的说法正确的是
| A.O3分子中存在非极性共价键,所以O3为非极性分子 |
| B.邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,所以前者的熔点高于后者 |
| C.乙烯分子中两个碳原子间以sp2杂化轨道形成的σ键较稳定,未杂化的2p轨道形成的π键易断裂,所以易发生加成反应 |
| D.金属Li中的金属键比金属K中的金属键强,所以单质Li的还原性比K强 |
您最近一年使用:0次
2024-05-02更新
|
175次组卷
|
2卷引用:福建省莆田第二十五中学2023-2024学年高二下学期第一次质量检化学试题
名校
解题方法
7 . 氟是卤族元素中原子半径最小的元素,氟的化合物种类繁多,用途广泛。回答下列问题:
(1)基态氟原子价电子的电子排布图为___________ ,其电子占据的最高能级的电子云轮廓图为___________ 。
(2) 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为___________ , 熔沸点比
熔沸点比 高的原因是
高的原因是___________ 。
(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:___________ 。晶体中不存在的化学键有___________ (填序号)
a.离子键 b. 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键
(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为___________ (图中交叉点均为碳原子)。 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  。
。
(1)基态氟原子价电子的电子排布图为
(2)
 和
和 均为离子晶体,其熔沸点如下表:
均为离子晶体,其熔沸点如下表:| 熔点 | 沸点 | |
 | 993℃ | 1695℃ |
 | 1261℃ | 2260℃(分解) |
 、
、 、
、 的离子半径从大到小顺序为
的离子半径从大到小顺序为 熔沸点比
熔沸点比 高的原因是
高的原因是(3)氟虫腈是一种广谱性杀虫剂,其结构简式如图甲:

a.离子键 b.
 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键(4)全氟辛酸(如图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为

 具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为
具有萤石结构晶胞如图丙所示。已知晶胞参数为anm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 。
。
您最近一年使用:0次
名校
解题方法
8 . 元素化学是化学的基石,不同的元素往往呈现出五彩缤纷的特性。回答下列问题:
(1) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ ,还原性由强到弱的顺序为___________ 。
(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:___________ 。
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
(4)已知 ,
, 的N原子杂化方式为
的N原子杂化方式为___________ ;比较键角 :
: 中的
中的
___________  中的
中的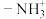 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由___________ 。
(5) 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是___________ ;___________ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
A. | B.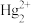 | C. | D. |
(4)已知
 ,
, 的N原子杂化方式为
的N原子杂化方式为 :
: 中的
中的
 中的
中的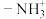 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由(5)
 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为 )。
)。
您最近一年使用:0次
名校
解题方法
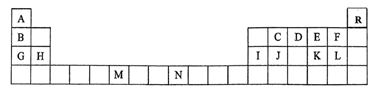
9 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)请根据对角线规则写出Be与NaOH 溶液反应的化学方程式___________ 。
(2)D的气态氢化物的VSEPR模型为___________ ,其中心原子的杂化类型为___________ 。
(3)G、H和Ⅰ的第一电离能数值由大到小的顺序为:___________ (用元素符号作答)。
(4)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是___________(填编号)。
(5)要证明太阳上是否含有R元素,可采用的方法是___________ 。
(6)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________ (填元素符号)。
(7)C元素是形成有机物的主要元素,下列分子中含有sp和 杂化方式的是
杂化方式的是___________ (填字母)。
(1)请根据对角线规则写出Be与NaOH 溶液反应的化学方程式
(2)D的气态氢化物的VSEPR模型为
(3)G、H和Ⅰ的第一电离能数值由大到小的顺序为:
(4)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是___________(填编号)。
A. | B. | C. | D.苯 |
(6)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有
(7)C元素是形成有机物的主要元素,下列分子中含有sp和
 杂化方式的是
杂化方式的是a. b.
b. c.
c. d.
d.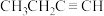
您最近一年使用:0次
名校
解题方法
10 . N、P同属于第VA族元素。试回答下列问题。
(1)基态N原子核外电子的空间运动状态有___________ 种。
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角___________ (填“>”“<”或“=”)NH3分子中的H—N—H键角。1mol[Co(NH3)5Cl]Cl2中含有的σ键数目为___________ NA。
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3___________ (填“高”或“低”),原因是___________ 。
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其主要原因是___________ 。
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:___________ 。
(1)基态N原子核外电子的空间运动状态有
(2)NH3分子可与Co3+形成配合物[Co(NH3)5Cl]Cl2,该配合物中H—N—H键角
(3)磷和氢能组成一系列的氢化物,如PH3、P2H4、P12H16等。其中最重要的PH3。P2H4的沸点比PH3
(4)乙二胺(H2NCH2CH2NH2)分子中氮原子的杂化类型为
(5)氮化硼、磷化铝、磷化镓(镓为第ⅢA族元素)晶胞结构都与金刚石的晶胞相似,熔点如下表所示,分析其变化的原因:
| 物质 | 氮化硼 | 磷化铝 | 磷化镓 |
| 熔点 | 3000℃ | 2000℃ | 1477℃ |
您最近一年使用:0次



