名校
1 . 氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过______ 方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______ 。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______ ,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______ (各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______ ;氟化铵中存在______ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键
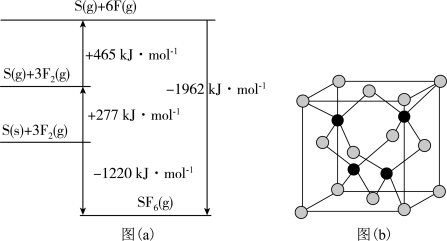
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能。则F-F键的键能为______ kJ•mol-1,S-F键的键能为______ kJ•mol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g•cm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加 德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______ nm(列出计算式)。
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态F原子的价层电子排布图(轨道表达式)为
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是
A.离子键 B.σ键 C.π键 D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能。则F-F键的键能为

(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g•cm-3。
①CuF的熔点比CuCl的高,原因是
②已知NA为阿伏加 德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=
您最近一年使用:0次
2019-10-28更新
|
351次组卷
|
2卷引用:西藏自治区拉萨中学2020届高三上学期第四次月考理综化学试题
名校
2 . 铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.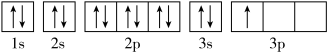
B.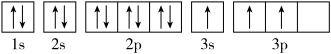
C.
D.
其中能量最低的是____ (填字母),电子由状态C到状态B所得原子光谱为____ 光谱(填“发射”或“吸收”) ,状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合_____ 。
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
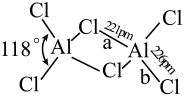
①a键的键能_____ b键的键能(填“>”“<”或“=”),其理由是_______ 。
②Al2Cl6中铝原子的杂化方式为___ ;AlCl3的空间结构为______ 。
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为_____ ,一个冰晶石晶胞中Na+的个数为_____ 。
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=____ pm(列出算式即可,阿伏伽德罗常数值为6.02×1023)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.

B.

C.

D.

其中能量最低的是
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。

①a键的键能
②Al2Cl6中铝原子的杂化方式为
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=
您最近一年使用:0次
2019-02-12更新
|
956次组卷
|
6卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题
3 . 碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________ ,据此推测,锡的常见正价是__________ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________ ;P、S的第一电离能(I1)的大小为I1(P) __________ I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________ ;乙烯分子中σ键与π键数目之比为__________ 。
(4)NH3的沸点__________ (填“高于”或“低于”)PH3的沸点,原因是____________________ 。
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________ 的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________ nm(用含NA的代数式表示)。

(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(3)CO32-中C原子的杂化轨道类型为
(4)NH3的沸点
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
名校
4 . 硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____ ,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________ 。硫所在周期中,第一电离能最大的元素是___________ 。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________ 。
(3)H2S中S原子的杂化类型是__________ ;H2S的VSEPR模型名称为_________ ;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________ 。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________ 个配位键,___________ 个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________ 。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____ 个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____ cm。
(1)当基态原子的电子吸收能量后,电子会发生
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式
(3)H2S中S原子的杂化类型是
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为
您最近一年使用:0次
2017-05-10更新
|
1410次组卷
|
3卷引用:西藏山南地区第二高级中学2017届高三第三次模拟考试理综化学试题
5 . 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________ 种不同运动状态的电子,基态T原子有________ 种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________ (用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________ 。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________ 。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________ 。
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________ ,
(7)X单质的晶胞如图所示,一个X晶胞中有________ 个X原子。
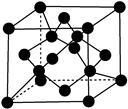
(1)Y原子核外共有
(2)X、Y、Z的第一电离能由小到大的顺序为
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为
(4)Z与R能形成化合物甲,1 mol甲中含
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为
(7)X单质的晶胞如图所示,一个X晶胞中有

您最近一年使用:0次
2016-12-09更新
|
227次组卷
|
2卷引用:2017届西藏自治区拉萨中学高三上第一次月考化学卷
6 .
(1)①NH3分子的空间构型是_______________ ;
②化合物NF3为______ 分子(填“极性”或“非极性”),若其沸点为-129 ℃,则其晶体类型为_______ 。
(2)已知尿素的结构式为: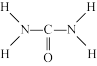 ,
,
①基态氮原子的价电子排布图是_________________ 。
②其中C、N、O三种元素的电负性由大到小顺序是________________________ 。
③尿素分子中C和N原子的杂化方式分别是____________ 、_______________ 。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子的电子式为___________ 。
②肼可用作火箭燃料, 肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在____________ (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(1)①NH3分子的空间构型是
②化合物NF3为
(2)已知尿素的结构式为:
 ,
,①基态氮原子的价电子排布图是
②其中C、N、O三种元素的电负性由大到小顺序是
③尿素分子中C和N原子的杂化方式分别是
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子的电子式为
②肼可用作火箭燃料, 肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
您最近一年使用:0次



