1 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置______________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型_______________ 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有_________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________________ 。
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为______________ , X的储氢质量分数是______________ ,c= ___________ pm (列出计算式即可)。
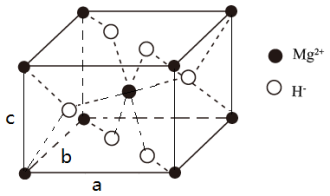
回答问题: .
(1) Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为

您最近一年使用:0次
2020-10-12更新
|
4071次组卷
|
5卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)(已下线)2020年海南卷化学高考真题变式题15-19(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
解题方法
2 . (1) 可用作食盐的抗结剂,高温下
可用作食盐的抗结剂,高温下 会分解生成
会分解生成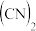 、KCN、
、KCN、 、
、 C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为
C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______ ; 中,铁原子不是采用
中,铁原子不是采用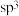 杂化的理由是
杂化的理由是______ 。
(2) 气态为单分子时,分子中S原子的杂化轨道类型为
气态为单分子时,分子中S原子的杂化轨道类型为______ ,分子的立体构型为______ ; 的三聚体环状结构如图1所示,该结构中
的三聚体环状结构如图1所示,该结构中 键长有a、b两类,b的键长大于a的键长的可能原因为
键长有a、b两类,b的键长大于a的键长的可能原因为______ 。

(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”
键” 或大
或大 键
键 。大
。大 键可用
键可用 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大 键表示为
键表示为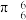 。
。
①下列微粒中存在“离域 键”的是
键”的是______ ;
A.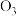

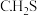

②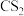 分子中大
分子中大 键可以表示为
键可以表示为______ ;
(4)铁、钾两种单质的堆积方式剖面图分别如图2、图3所示。铁晶体中原子的空间利用率为______  用含
用含 的式子表示
的式子表示 。
。
 可用作食盐的抗结剂,高温下
可用作食盐的抗结剂,高温下 会分解生成
会分解生成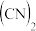 、KCN、
、KCN、 、
、 C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为
C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为 中,铁原子不是采用
中,铁原子不是采用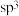 杂化的理由是
杂化的理由是(2)
 气态为单分子时,分子中S原子的杂化轨道类型为
气态为单分子时,分子中S原子的杂化轨道类型为 的三聚体环状结构如图1所示,该结构中
的三聚体环状结构如图1所示,该结构中 键长有a、b两类,b的键长大于a的键长的可能原因为
键长有a、b两类,b的键长大于a的键长的可能原因为
(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”
键” 或大
或大 键
键 。大
。大 键可用
键可用 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大 键表示为
键表示为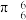 。
。①下列微粒中存在“离域
 键”的是
键”的是A.
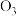

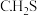

②
 分子中大
分子中大 键可以表示为
键可以表示为(4)铁、钾两种单质的堆积方式剖面图分别如图2、图3所示。铁晶体中原子的空间利用率为
 用含
用含 的式子表示
的式子表示 。
。
您最近一年使用:0次
2020-01-13更新
|
531次组卷
|
3卷引用:2020年海南卷化学高考真题变式题15-19
名校
3 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
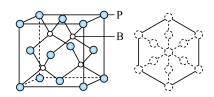
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2517次组卷
|
8卷引用:2020年海南卷化学高考真题变式题15-19
(已下线)2020年海南卷化学高考真题变式题15-19【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题江西省上饶市2020届第一次高考模拟考试理科综合化学试题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
4 . 碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________ ,据此推测,锡的常见正价是__________ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________ ;P、S的第一电离能(I1)的大小为I1(P) __________ I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________ ;乙烯分子中σ键与π键数目之比为__________ 。
(4)NH3的沸点__________ (填“高于”或“低于”)PH3的沸点,原因是____________________ 。
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________ 的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________ nm(用含NA的代数式表示)。

(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(3)CO32-中C原子的杂化轨道类型为
(4)NH3的沸点
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
解题方法
5 . 卤族元素的单质和化合物在生产生活中有重要的用途。
(1)基态溴原子的核外电子排布式为[Ar]_________ 。
(2)在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是_________ 。
(3)HIO3的酸性_________ (填“强于”或“弱于”) HIO4,原因是_________ 。
(4)ClO2-中心氯原子的杂化类型为_________ ,ClO3-的空间构型为_________ 。
(5)晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为( ,
, ,0);C处为(1,1,1)。则D处微粒的坐标参数为
,0);C处为(1,1,1)。则D处微粒的坐标参数为_________ 。


②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3,则晶胞中Ca2+与离它最近的F-之间的距离为_________ nm (设NA为阿伏伽德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。
(1)基态溴原子的核外电子排布式为[Ar]
(2)在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是
(3)HIO3的酸性
(4)ClO2-中心氯原子的杂化类型为
(5)晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(
 ,
, ,0);C处为(1,1,1)。则D处微粒的坐标参数为
,0);C处为(1,1,1)。则D处微粒的坐标参数为

②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3,则晶胞中Ca2+与离它最近的F-之间的距离为
您最近一年使用:0次
2018-01-23更新
|
410次组卷
|
3卷引用:2020年海南卷化学高考真题变式题15-19
6 . 氢能的存储是其应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________ ,该能层具有的原子轨道数为________ 。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是( )
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________ 。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强下,NH3沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是
您最近一年使用:0次



