名校
解题方法
1 . 新型半导体材料如碳化硅(SiC)、氮化镓(GaN)等在国防技术、航空航天及5G技术等领域扮演着重要的角色。回答下列问题:
(1)基态Si原子中,核外电子占据的最高能层的符号为____ ,占据最高能级的电子的电子云轮廓图形状为____ ;基态Ga原子的核外电子排布为[Ar]3d104s24p1,其转化为下列激发态时,吸收能量最少的是____ (填选项字母)。
A.[Ar] B.[Ar]
B.[Ar]
C.[Ar] D.[Ar]
D.[Ar]
(2)C与Si是同主族元素,C原子之间可以形成双键、叁键,但Si原子之间难以形成双键、叁键。从原子结构分析,其原因为____ 。
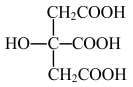
(3)硼(B)与Ga是同主族元素,硼氢化钠(NaBH4)是有机合成中重要的还原剂,其阴离子BH 的立体构型为
的立体构型为____ ;另一种含硼阴离子的结构如图所示,其中B原子的杂化方式为____ 。

(4)GaCl3的熔点为77.9℃,GaF3的熔点为1000℃,试分析GaCl3熔点低于GaF3的原因为____ ;气态GaCl3常以二聚体形式存在,二聚体中各原子均满足8e-结构,据此写出二聚体的结构式为____ 。
(5)B和Mg形成的化合物刷新了金属化合物超导温度的最高记录。该化合物的晶体结构单元如图所示,其中Mg原子间形成正六棱柱,6个B原子分别位于六个三棱柱体心。则该化合物的化学式可表示为____ ;相邻B原子与Mg原子间的最短距离为____ nm(用含x、y的代数式表示)。

(1)基态Si原子中,核外电子占据的最高能层的符号为
A.[Ar]
 B.[Ar]
B.[Ar]
C.[Ar]
 D.[Ar]
D.[Ar]
(2)C与Si是同主族元素,C原子之间可以形成双键、叁键,但Si原子之间难以形成双键、叁键。从原子结构分析,其原因为
(3)硼(B)与Ga是同主族元素,硼氢化钠(NaBH4)是有机合成中重要的还原剂,其阴离子BH
 的立体构型为
的立体构型为
(4)GaCl3的熔点为77.9℃,GaF3的熔点为1000℃,试分析GaCl3熔点低于GaF3的原因为
(5)B和Mg形成的化合物刷新了金属化合物超导温度的最高记录。该化合物的晶体结构单元如图所示,其中Mg原子间形成正六棱柱,6个B原子分别位于六个三棱柱体心。则该化合物的化学式可表示为

您最近一年使用:0次
2022-05-13更新
|
1494次组卷
|
3卷引用:2024届陕西省西安中学高三下学期三模理综试题-高中化学
名校
解题方法
2 . (1)硅主要以硅酸盐、___________ 等化合物的形式存在于地壳中。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献___________ 个原子。
(3)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________ 。
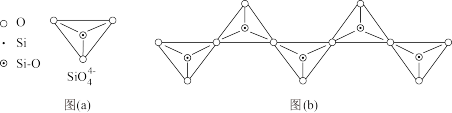
(4)在硅酸盐中,SiO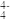 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为___________ ,Si与O的原子数之比为___________ ,化学式为___________ 。
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为 ;C为
;C为 。则D原子坐标参数为
。则D原子坐标参数为___________ 。②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为___________ g·cm-3(列出计算式即可,锗的相对原子质量为73)。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献
(3)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为
(4)在硅酸盐中,SiO
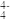 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为
 ;C为
;C为 。则D原子坐标参数为
。则D原子坐标参数为
您最近一年使用:0次
名校
解题方法
3 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。
(1)Fe基态核外电子排布式为________ ;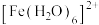 中与Fe2+配位的原子是
中与Fe2+配位的原子是______ (填元素符号)。
(2)H2O2是________ 分子(填“极性”“非极性”),电子式为_______ 。
(3)NH3分子中氮原子的轨道杂化类型是_______ ;C、N、O元素的第一电离能由大到小的顺序为___________ 。
(4)与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(5)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键为_________ mol。
(1)Fe基态核外电子排布式为
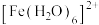 中与Fe2+配位的原子是
中与Fe2+配位的原子是(2)H2O2是
(3)NH3分子中氮原子的轨道杂化类型是
(4)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(5)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键为

您最近一年使用:0次
2020-08-27更新
|
78次组卷
|
2卷引用:陕西省宝鸡市渭滨中学2021届高三上学期第三次月考化学试题
名校
解题方法
4 . LiFePO4、聚乙二醇、LiPF6、LiAsF6、LiCl等常用作锂离子聚合物电池的材料和载体。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为___________ 。
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为___________ 。
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有________ 。
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(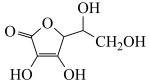 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是____________________ ,该分子中碳原子的杂化方式为___________ 。
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
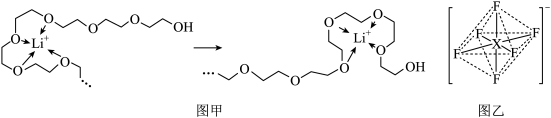
①从化学键角度看,Li+迁移过程发生___________ (填“物理变化”或“化学变化”)。
②相同条件,Li+在___________ (选填“LiPF6”或“LiAsF6”)中迁移较快,原因是___________ 。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。
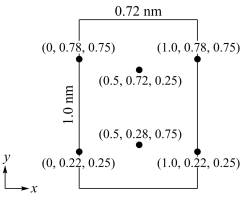
①该晶胞中Cl原子的数目为___________ 。
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为___ g·cm-3(列出计算表达式)。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。

①该晶胞中Cl原子的数目为
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为
您最近一年使用:0次
名校
解题方法
5 . 铬、钼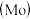 、钨
、钨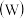 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
 铬元素的最高化合价为
铬元素的最高化合价为________ ;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________ 个未成对电子。
 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
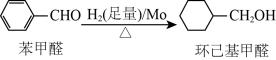
 环己基甲醇分子中采取
环己基甲醇分子中采取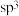 杂化的原子是
杂化的原子是________  写元素符号
写元素符号 。
。
 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是________ 。
 铬离子
铬离子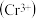 能形成多种配合物,例如
能形成多种配合物,例如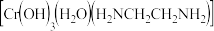 。
。
 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为________ 。
 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为________ 。
 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
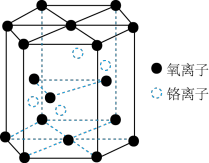
 该氧化物的化学式为
该氧化物的化学式为________ 。
 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为________  用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
 、钨
、钨 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。 铬元素的最高化合价为
铬元素的最高化合价为 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
 环己基甲醇分子中采取
环己基甲醇分子中采取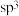 杂化的原子是
杂化的原子是 写元素符号
写元素符号 。
。 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是 铬离子
铬离子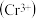 能形成多种配合物,例如
能形成多种配合物,例如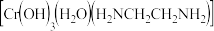 。
。 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
 该氧化物的化学式为
该氧化物的化学式为 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为 用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
您最近一年使用:0次
2020-02-03更新
|
740次组卷
|
5卷引用:陕西省咸阳市武功县2021-2022学年高三上学期第一次质量检测化学试题
名校
解题方法
6 . 早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态Fe原子有_______ 个未成对电子,Fe3+的价电子排布式为__________ 。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为___ 。乙醛中碳原子的杂化轨道类型为_____ ,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_________ ,1 mol该物质中有______ 个σ键。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______ 个铜原子。
(4)CaCl2熔点高于AlCl3的原因__________________________________ 。
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏伽德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________ pm(只要求列出计算式即可)。
(1)基态Fe原子有
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有
(4)CaCl2熔点高于AlCl3的原因
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏伽德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为

您最近一年使用:0次
2018-10-11更新
|
688次组卷
|
3卷引用:陕西省商南县高级中学2019届高三上学期四模考试理科综合化学试题
名校
7 . [物质结构与性质](1)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如图所示)中羧基氧原子的轨道杂化类型分别是______________
(2)氰酸(HOCN)的结构式是_________ ,根据等电子体原理,可推测氰酸根离子的空间构型是____ 。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为_____________ .
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键.二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种.
①二茂铁的分子式为__________ .
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷.因此每个环含有________ 个π电子.
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8~20kJ/mol.温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c.比较稳定的是__________ 结构(填“重叠”或“错位”).
(5)氧化镍(NiO)是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。基态Ni2+有_________ 个未成对电子,已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 ____________ m2/g。

(2)氰酸(HOCN)的结构式是

(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键.二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种.
①二茂铁的分子式为
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷.因此每个环含有
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8~20kJ/mol.温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c.比较稳定的是
(5)氧化镍(NiO)是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。基态Ni2+有
您最近一年使用:0次
2017-02-26更新
|
767次组卷
|
2卷引用:陕西省西安市铁一中学2019—2020学年高三上学期第四次月考化学试题
填空题
|
较难(0.4)
|
名校
8 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
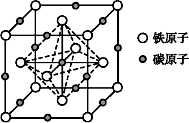
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

您最近一年使用:0次
2017-02-24更新
|
2504次组卷
|
11卷引用:陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题
陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题2017届安徽省A10联盟高三下学期开年考试理综化学试卷2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷江西省上饶市重点中学2018届高三六校第一次联考理综化学试题吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测2020年全国卷Ⅰ理综化学高考真题变式题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
9 . [物质结构与性质]
已知碳元素能形成多种金属碳化物,如碳化钙,俗称为电石。
(1)电石(CaC2)是用CaO与焦炭在电炉中加强热反应生成的,写出此反应的化学方程式 ,CaC2中含有化学键的类型为 ,C22-与N2互为等电子体,C22-的电子式可表示为 ,其中σ键和π键数目之比为 。
(2)已知MgO、CaO的熔点分别为2852℃、2614℃,分析熔点差异的原因是 。
(3)苯丙氨酸是一种重要的氨基酸,其结构如图所示,分子中第一电离能最大的原子价电子排布式是 ,其中碳原子的杂化方式有 。

(4)已知CaF2晶体(如图,Ca2+处于面心)的密度为ρg/cm3,NA为阿伏加德常数,相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量(M)可以表示为 g/mol。

已知碳元素能形成多种金属碳化物,如碳化钙,俗称为电石。
(1)电石(CaC2)是用CaO与焦炭在电炉中加强热反应生成的,写出此反应的化学方程式 ,CaC2中含有化学键的类型为 ,C22-与N2互为等电子体,C22-的电子式可表示为 ,其中σ键和π键数目之比为 。
(2)已知MgO、CaO的熔点分别为2852℃、2614℃,分析熔点差异的原因是 。
(3)苯丙氨酸是一种重要的氨基酸,其结构如图所示,分子中第一电离能最大的原子价电子排布式是 ,其中碳原子的杂化方式有 。

(4)已知CaF2晶体(如图,Ca2+处于面心)的密度为ρg/cm3,NA为阿伏加德常数,相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量(M)可以表示为 g/mol。

您最近一年使用:0次
名校
10 . 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式___________ 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是___________ ;
②写出Al2Cl6分子的结构式___________ ;
③单分子A1Cl3的立体构型是___________ ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是___________ 。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有___________ 种不同的结构类型。
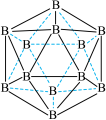
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)___________ ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=___________ pm。
(1)写出基态镓原子的电子排布式
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是
②写出Al2Cl6分子的结构式
③单分子A1Cl3的立体构型是
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)
您最近一年使用:0次
2016-12-09更新
|
450次组卷
|
6卷引用:【全国百强校】陕西省陕西师大附属中学2019届高三上学期月考化学试题



