名校
解题方法
1 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________ ,基态时该阳离子的价电子排布式为___________ 。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____ 元素。
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是________________________________________ 。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2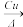 2CH3CHO+2H2O。
2CH3CHO+2H2O。
①乙醇的沸点高于乙醛,其主要原因是_________________________________ ;乙醛分子中π键与σ键的个数比为___________ 。
②乙醛分子中碳原子的杂化轨道类型是___________ 。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
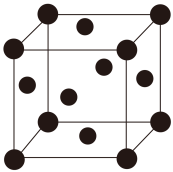
①该铜银合金的化学式是___________________ 。
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加 德罗常数(NA)为_______ mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为___________ 。(提示:晶胞中原子空间利用率=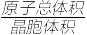 ×100%)
×100%)
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2
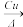 2CH3CHO+2H2O。
2CH3CHO+2H2O。①乙醇的沸点高于乙醛,其主要原因是
②乙醛分子中碳原子的杂化轨道类型是
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加 德罗常数(NA)为
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为
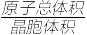 ×100%)
×100%)
您最近一年使用:0次
2020-05-28更新
|
1376次组卷
|
6卷引用:广西桂林、崇左、贺州市2020届高三下学期第二次联合调研考试理综化学试题
名校
2 . 硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________ ,该能层为次外层时最多可以容纳的电子数为_________ 。元素Ca和S相比,第一电离能较大的是______ (填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______ (填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______ ,但H2O分子键角大于H2S分子,原因是________________ 。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________ 。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
由表可知:r(S2-)____ r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________ ,r(S2- )为_____ nm,r(Ca2+)为_____ nm。
(1)基态Ca原子中,核外电子占据最高能层的符号是
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
| 氧化物晶体 | CaO | MnO | MgO |
| a/nm | 0.421 | 0.444 | 0.480 |
| 硫化物晶体 | MgS | MnS | CaS |
| a/nm | 0.520 | 0.520 | 0.568 |
您最近一年使用:0次
名校
3 . 早期发现的一种天然二十面体准晶颗粒由三种Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________ 方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有_________ 个未成对电子,Fe3+的电子排布式为_______________ 。可用硫氰化钾检验Fe3+,形成的配合物的颜色为_______________ 。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________ ,乙醛分子中各元素的电负性由大到小的顺序为_______________ 。乙酸的沸点明显高于乙醛,其主要原因是_____________________________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________ 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为__________ 。列式表示Al单质的密度_______________ g·cm-3。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态Fe原子有
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为
您最近一年使用:0次
填空题
|
较难(0.4)
|
名校
4 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
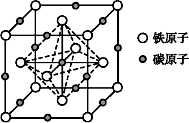
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

您最近一年使用:0次
2017-02-24更新
|
2504次组卷
|
11卷引用:广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题2017届安徽省A10联盟高三下学期开年考试理综化学试卷2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷江西省上饶市重点中学2018届高三六校第一次联考理综化学试题吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题2020年全国卷Ⅰ理综化学高考真题变式题



