名校
1 . (1)在现用周期表中氧族元素包括 ______________________ (填元素名称)五种元素,其中Se的基态原子的电子排布式为______________________ ,元素X与Se同周期,X元素原子核外未成对电子数最多,X为______________________ (填元素符号)。
(2)与氧同周期的相邻元素中,第一电离能有大到小的顺序______________________ 。
(3)臭鼬排放的臭气主要成分为3—MBT(3—甲基—2—丁烯硫醇,结构如图)。1mol3—MBT中含有σ键数目为____________ (NA为阿伏加德罗常数的值)。沸点:3—MBT____________ (CH3)2C==CHCH2OH(填“>”“<”或“=”),主要原因是________________________ 。

(4)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法正确的是__________ (填序号)。
A.中心原子的价层电子对数不相等
B.都是极性分子
C.中心原子的核对电子数目不相等
D.都含有极性键
②SO3分子的空间构型为__________ ,与其互为等电子体的阴离子为__________ (举一例)。
(5)单质Po是有__________ 键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏加德罗常数的值为NA,则钋晶体的密度的表达式为____________________ g·cm-3。
(2)与氧同周期的相邻元素中,第一电离能有大到小的顺序
(3)臭鼬排放的臭气主要成分为3—MBT(3—甲基—2—丁烯硫醇,结构如图)。1mol3—MBT中含有σ键数目为

(4)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法正确的是
A.中心原子的价层电子对数不相等
B.都是极性分子
C.中心原子的核对电子数目不相等
D.都含有极性键
②SO3分子的空间构型为
(5)单质Po是有
您最近一年使用:0次
2019-04-05更新
|
314次组卷
|
2卷引用:【全国百强校】贵州省贵阳市第一中学2019届高三下学期第六次月考(3月)理科综合化学试题
10-11高三上·江苏无锡·期中
名校
2 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________ ;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO______ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________ 、_________ ;
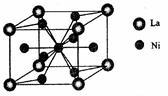
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________ ;
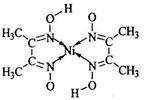
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是________ ,氮镍之间形成的化学键是______ ;
②该结构中,氧氢之间除共价键外还可存在__________ ;
③该结构中,碳原子的杂化轨道类型有______________ 。
(1)Ni原子的核外电子排布式为
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(3)NiO晶胞中Ni和O的配位数分别为
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为


(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是
②该结构中,氧氢之间除共价键外还可存在
③该结构中,碳原子的杂化轨道类型有
您最近一年使用:0次
2019-01-30更新
|
1038次组卷
|
5卷引用:贵州省遵义正安县一中2020届高三上学期开学考试化学试题
贵州省遵义正安县一中2020届高三上学期开学考试化学试题(已下线)2011届江苏省无锡一中高三上学期期中考试化学卷(已下线)2014高考名师推荐化学--预测16海南省儋州市鑫源中学2021-2022学年高二下学期期中考试化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷
名校
3 . 下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:

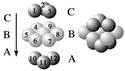
图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________ ,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________ 。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________ ,H3BO3晶体中B原子个数与极性键个数比为____________ 。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________ 理论。
(4)三种晶体中熔点最低的是________ (填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________ 。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________ 。


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用
(4)三种晶体中熔点最低的是
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为
您最近一年使用:0次
2018-09-26更新
|
449次组卷
|
16卷引用:贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题
贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题贵州省黔南布依族苗族自治州贵定县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市通海县第二中学2019届高三9月月考化学试题云南省西畴县第二中学2020届高三上学期开学考试化学试题云南省文山壮族苗族自治州砚山县第二中学2020届高三上学期开学考试化学试题云南省文山州马关县实验高中2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题云南省宾川县三中2020届高三上学期开学考试化学试题云南省盈江县一中2020届高三上学期开学考试化学试题云南省临沧市凤庆县第二中学2019-2020学年高三第一学期开学考试化学试题云南省马关县第二中学2019-2020学年高三上学期期末考试理综化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题云南省广南县第一中学2021-2022学年高三下学期3月考试理综化学试题
名校
4 . Ⅰ.国产C919大型客机的正式下线,标志着我国航空工业进入了新的发展阶段,我国成为世界上少数几个具有自行研制大型飞机的国家之一。
(1)飞机的外壳通常采用镁一铝合金材料,铝的价电子排布图为_______________ ,第一电离能:铝________ (填“大于”或“小于”)镁。
(2)为了减轻质量而不减轻外壳承压能力,现代飞机通常采用复合材料一玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图甲所示,其中碳原子的杂化方式为___________ ,该材料此部分中所含元素的电负性从小到大的顺序为_______________ 。

II.大型飞机的发动机在制造过程中通常采用碳化钨做关键部位的材料。
(1)钨元素位于周期表的第六周期第VIB族,请写出其位于同一族的元素铬的原子的价电子排布式__________________ ,
(2)图乙为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有_______ 个,1个钨原子周围距离钨原子最近的碳原子有_______ 个,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是___________ (填序号)。
A.Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(4)设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏伽德罗常数NA用上述数据可以表示为____________________ 。
(1)飞机的外壳通常采用镁一铝合金材料,铝的价电子排布图为
(2)为了减轻质量而不减轻外壳承压能力,现代飞机通常采用复合材料一玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如图甲所示,其中碳原子的杂化方式为

II.大型飞机的发动机在制造过程中通常采用碳化钨做关键部位的材料。
(1)钨元素位于周期表的第六周期第VIB族,请写出其位于同一族的元素铬的原子的价电子排布式
(2)图乙为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有
A.Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(4)设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏伽德罗常数NA用上述数据可以表示为
您最近一年使用:0次
名校
解题方法
5 . 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150 ℃时释氢,在170 ℃、15.2 MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子轨道表示式为____________________ 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于__________ 晶体,其电子式为__________ 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为__________ (标明配位键)。
(4) 中,Al的轨道杂化方式为
中,Al的轨道杂化方式为__________ ;例举与 空间构型相同的两种离子:
空间构型相同的两种离子:__________ (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的 有
有______ 个;NaAlH4晶体的密度为_________ g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为__________ (填化学式)。
(6)NaAlH4的释氢机理为:每3个 中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为____________ 。

(1)基态Ti原子的价电子轨道表示式为
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为
(4)
 中,Al的轨道杂化方式为
中,Al的轨道杂化方式为 空间构型相同的两种离子:
空间构型相同的两种离子:(5)NaAlH4晶体中,与Na+紧邻且等距的
 有
有(6)NaAlH4的释氢机理为:每3个
 中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
您最近一年使用:0次
2016-12-09更新
|
1005次组卷
|
5卷引用:【全国百强校】贵州省遵义航天高级中学2018届高三第十一次模拟考试理科综合化学试题
【全国百强校】贵州省遵义航天高级中学2018届高三第十一次模拟考试理科综合化学试题2016届福建省高中毕业班4月质量检查考试理综化学试卷(已下线)2018年12月8日 《每日一题》一轮复习- 周末培优(已下线)2019年12月7日 《每日一题》2020年高考化学一轮复习——周末培优广东省实验中学2016-2017学年高二下学期期中考试化学试题
名校
6 . 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式___________ 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是___________ ;
②写出Al2Cl6分子的结构式___________ ;
③单分子A1Cl3的立体构型是___________ ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是___________ 。
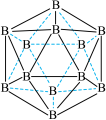
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有___________ 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)___________ ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=___________ pm。
(1)写出基态镓原子的电子排布式
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是
②写出Al2Cl6分子的结构式
③单分子A1Cl3的立体构型是
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm−3,计算确定其晶胞的类型(简单、体心或面心立方)
您最近一年使用:0次
2016-12-09更新
|
450次组卷
|
6卷引用:2016届贵州省遵义一中高三押题卷理综化学试卷
真题
名校
7 . 氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______ 。
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是__________________________ (用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___________ ,其中氧原子的杂化方式为_________ 。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为_________ kJ·mol-1。ClF3的熔、沸点比BrF3的________ (填“高”或“低”)。
(1)下列关于CaF2的表述正确的是
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为
您最近一年使用:0次
2016-12-09更新
|
1638次组卷
|
10卷引用:贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题
贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题2015年全国普通高等学校招生统一考试化学(山东卷)(已下线)二轮复习 专题17 物质结构与性质 押题专练吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题山西省原平市范亭中学2016-2017学年高二下学期期末考试化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:3.4 离子晶体福建省莆田第一中学2019-2020学年高二下学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题



