2024高三·全国·专题练习
1 .  为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是_______ 。
A.(2023·全国卷)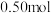 异丁烷分子中共价键的数目为
异丁烷分子中共价键的数目为
B.(2023·广东卷)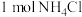 含有的共价键数目为
含有的共价键数目为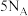
C.(2023·湖北卷)1molSi含Si-Si键的数目约为
D.(2023·辽宁卷)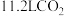 含
含 键数目为
键数目为
E.(2022·浙江卷)32g甲醇的分子中含有C—H键的数目为4NA
F.(2022·浙江卷) 乙烷和丙烯的混合气体中所含碳氢键数为
乙烷和丙烯的混合气体中所含碳氢键数为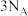
G.(2021·全国卷)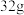 环状
环状 (
(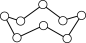 )分子中含有的
)分子中含有的 键数为
键数为
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.(2023·全国卷)
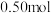 异丁烷分子中共价键的数目为
异丁烷分子中共价键的数目为
B.(2023·广东卷)
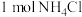 含有的共价键数目为
含有的共价键数目为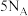
C.(2023·湖北卷)1molSi含Si-Si键的数目约为

D.(2023·辽宁卷)
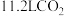 含
含 键数目为
键数目为
E.(2022·浙江卷)32g甲醇的分子中含有C—H键的数目为4NA
F.(2022·浙江卷)
 乙烷和丙烯的混合气体中所含碳氢键数为
乙烷和丙烯的混合气体中所含碳氢键数为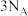
G.(2021·全国卷)
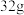 环状
环状 (
( )分子中含有的
)分子中含有的 键数为
键数为
您最近一年使用:0次
2024高三·全国·专题练习
2 . NA为阿伏加德罗常数的值。下列说法正确的是_______ 。
A.(2023·全国卷)标准状况下,2.24LSO3中电子的数目为4.00NA
B.(2023·广东卷)NaCl和NH4Cl的混合物中含1molCl-,则混合物中质子数为28NA
C.(2022·辽宁卷)1.8g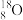 中含有的中子数为NA
中含有的中子数为NA
D.(2022·浙江6月)8g CH4含有中子数为3NA
E.(2022·海南卷)2.8g56Fe含有的中子数为1.3NA
F.(2021·天津卷)180g葡萄糖中,C原子的数目为6NA
G.(2021·广东卷)23gNa与足量H2O反应生成的H2分子数目为NA
H.(2021·河北卷)22.4L(标准状况)氟气所含的质子数为18NA
I.(2021·湖北卷)23gCH3CH2OH中sp3杂化的原子数为NA
J.(2021·湖北卷)0.5molXeF4中氙的价层电子对数为3NA
K.(2021·湖南卷)18gH218O含有的中子数为10NA
L.(2021·海南卷)0.1mol 27Al3+中含有的电子数为1.3NA
M.(2021·海南卷)0.1mol肼(H2N-NH2)含有的孤电子对数为0.2NA
N.(2021·全国甲卷)18g重水(D2O)中含有的质子数为10NA
A.(2023·全国卷)标准状况下,2.24LSO3中电子的数目为4.00NA
B.(2023·广东卷)NaCl和NH4Cl的混合物中含1molCl-,则混合物中质子数为28NA
C.(2022·辽宁卷)1.8g
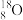 中含有的中子数为NA
中含有的中子数为NAD.(2022·浙江6月)8g CH4含有中子数为3NA
E.(2022·海南卷)2.8g56Fe含有的中子数为1.3NA
F.(2021·天津卷)180g葡萄糖中,C原子的数目为6NA
G.(2021·广东卷)23gNa与足量H2O反应生成的H2分子数目为NA
H.(2021·河北卷)22.4L(标准状况)氟气所含的质子数为18NA
I.(2021·湖北卷)23gCH3CH2OH中sp3杂化的原子数为NA
J.(2021·湖北卷)0.5molXeF4中氙的价层电子对数为3NA
K.(2021·湖南卷)18gH218O含有的中子数为10NA
L.(2021·海南卷)0.1mol 27Al3+中含有的电子数为1.3NA
M.(2021·海南卷)0.1mol肼(H2N-NH2)含有的孤电子对数为0.2NA
N.(2021·全国甲卷)18g重水(D2O)中含有的质子数为10NA
您最近一年使用:0次
2023高三·全国·专题练习
3 . 周期表中VIIA族元素及其化合物应用广泛。Cl2是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等;ClO2用作自来水消毒剂;NaClO、Ca(ClO)2既可用作漂白棉麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂;氯可形成多种含氧酸HClO、HClO2、HClO3、HClO4;AgBr可用作感光材料;AgI可用于人工降雨;KIO3常用作食盐中的补碘剂。
已知下列离子反应自发进行:
①CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO
② +HClO=
+HClO= +ClO-
+ClO-
下列说法正确的是____________ 。
A.由反应①可推断:Ka2(H2CO3)>Ka(HClO)
B.向新制饱和氯水中加入少量碳酸钙,固体不会溶解
C.向等物质的量浓度NaHCO3和NaClO混合液中加入CaCl2(s),可生成HClO
D.将CO2通入NaClO溶液中,发生反应:CO2+2NaClO+H2O=Na2CO3+HClO
E.AgBr呈淡黄色,可用作感光材料
F.Cl2易液化,可用作生产漂白液
G.ClO2具有强氧化性,可用作自来水消毒
H.KIO3易溶于水,可用作食盐中加碘
J. 中O-Cl-O夹角大于
中O-Cl-O夹角大于 中O-Cl-O夹角
中O-Cl-O夹角
K.ClO2是由极性键构成的非极性分子
M.碘原子(53I)基态核外电子排布式为5s25p5
N.前五周期的ⅦA族元素单质的晶体类型相同
已知下列离子反应自发进行:
①CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO
②
 +HClO=
+HClO= +ClO-
+ClO-下列说法正确的是
A.由反应①可推断:Ka2(H2CO3)>Ka(HClO)
B.向新制饱和氯水中加入少量碳酸钙,固体不会溶解
C.向等物质的量浓度NaHCO3和NaClO混合液中加入CaCl2(s),可生成HClO
D.将CO2通入NaClO溶液中,发生反应:CO2+2NaClO+H2O=Na2CO3+HClO
E.AgBr呈淡黄色,可用作感光材料
F.Cl2易液化,可用作生产漂白液
G.ClO2具有强氧化性,可用作自来水消毒
H.KIO3易溶于水,可用作食盐中加碘
J.
 中O-Cl-O夹角大于
中O-Cl-O夹角大于 中O-Cl-O夹角
中O-Cl-O夹角K.ClO2是由极性键构成的非极性分子
M.碘原子(53I)基态核外电子排布式为5s25p5
N.前五周期的ⅦA族元素单质的晶体类型相同
您最近一年使用:0次
2023高三·全国·专题练习
4 . CO2和CH3OH分子中C原子的杂化形式分别为___________ 和___________ 。
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 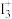 离子的中心原子的杂化形式为
离子的中心原子的杂化形式为___________ 。
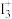 离子的中心原子的杂化形式为
离子的中心原子的杂化形式为
您最近一年使用:0次
2023高三·全国·专题练习
6 . LiAlH4中的阴离子的中心原子的杂化形式为___________ 。
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
7 . 有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ 。
 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
您最近一年使用:0次
名校
解题方法
8 . NH3、H2O 以及分子 PH3的空间结构和相应的键角如下图所示。
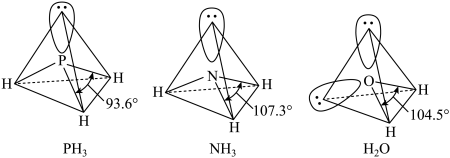
(1)PH3中P的杂化类型是___________ ,H2O 的键角小于 NH3,分析原因___________ 。
(2)H2O、PH3、KH按熔点由高到低的顺序排列为___________ 。
(3)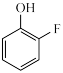 的分子内部存在氢键,画出含氢键的分子结构:
的分子内部存在氢键,画出含氢键的分子结构:___________ ,形成分子内氢键一般会使得熔点___________ 。(填“升高”或“降低”)

(1)PH3中P的杂化类型是
(2)H2O、PH3、KH按熔点由高到低的顺序排列为
(3)
 的分子内部存在氢键,画出含氢键的分子结构:
的分子内部存在氢键,画出含氢键的分子结构:
您最近一年使用:0次
2023高三·全国·专题练习
9 . 比较下列分子或离子中的键角大小(填“>”“<”或“=”):
①H2O___________ CS2,原因是___________ 。
②SO3___________  。③BF3
。③BF3___________ NCl3。
①H2O
②SO3
 。③BF3
。③BF3
您最近一年使用:0次
2023高三·全国·专题练习
10 . 回答下列问题:

(1)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________ 。
A.在I中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是________ 。

(1)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次



