名校
1 . 化合物F是合成盐酸多巴酚丁胺的中间体,其合成路线如下:
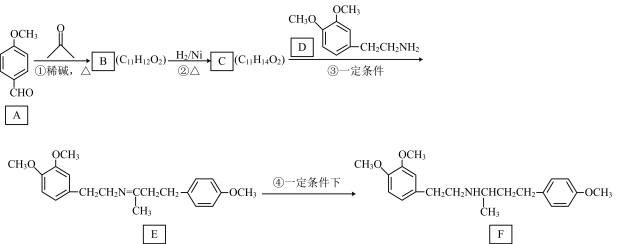
已知:①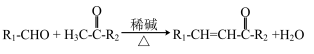
② (
( 、
、 、
、 、
、 均为烃基)
均为烃基)
回答下列问题:
(1)A中C原子的杂化方式为___________ 。
(2)D中的官能团名称为___________ ,B→C的反应类型为___________ 。
(3)B的结构简式为___________ 。
(4)C+D→E的化学方程式为___________ 。
(5)同时符合下列条件的D的同分异构体有___________ 种(不包括立体异构体),其中核磁共振氢谱的峰面积之比为9:2:2:2的结构简式为___________ (任写一种)。
①可以与氯化铁溶液发生显色反应;
②不含氮氧键;
③只有4种不同化学环境的氢原子。
(6)参照上述流程,设计以 为原料合成
为原料合成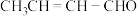 的流程图:
的流程图:______ (无机试剂、有机溶剂任选)。

已知:①

②
 (
( 、
、 、
、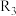 、
、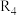 均为烃基)
均为烃基)回答下列问题:
(1)A中C原子的杂化方式为
(2)D中的官能团名称为
(3)B的结构简式为
(4)C+D→E的化学方程式为
(5)同时符合下列条件的D的同分异构体有
①可以与氯化铁溶液发生显色反应;
②不含氮氧键;
③只有4种不同化学环境的氢原子。
(6)参照上述流程,设计以
 为原料合成
为原料合成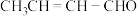 的流程图:
的流程图:
您最近一年使用:0次
2023-04-11更新
|
401次组卷
|
2卷引用:湖北省新高考联考协作体2022-2023学年高三下学期4月月考化学试题
解题方法
2 . 化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线如图:

(1)B中的含氧官能团名称为硝基、___________ 和___________ 。
(2)写出C→D的反应方程式___________ 。
(3)D→E的反应类型为___________ 。
(4)F中氮原子的杂化类型是___________ 。
(5)G经氧化得到H,写出G的结构简式___________ 。
(6)写出同时满足下列条件的C的一种同分异构体的结构简式___________ 。
①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应;
③水解产物之一是α-氨基酸,另一水解产物分子的核磁共振氢谱只有2组峰。
(7)已知:

 (R代表烃基,Rˊ代表烃基或H)。请写出以
(R代表烃基,Rˊ代表烃基或H)。请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线
的合成路线___ (无机试剂任用,合成路线示例见本题题干)。

(1)B中的含氧官能团名称为硝基、
(2)写出C→D的反应方程式
(3)D→E的反应类型为
(4)F中氮原子的杂化类型是
(5)G经氧化得到H,写出G的结构简式
(6)写出同时满足下列条件的C的一种同分异构体的结构简式
①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应;
③水解产物之一是α-氨基酸,另一水解产物分子的核磁共振氢谱只有2组峰。
(7)已知:


 (R代表烃基,Rˊ代表烃基或H)。请写出以
(R代表烃基,Rˊ代表烃基或H)。请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线
的合成路线
您最近一年使用:0次
2022-01-11更新
|
343次组卷
|
2卷引用:湖北省部分市州2021-2022学年高三上学期期末联合调研考试化学试题
解题方法
3 . 随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:______________________ 。
(2)与CO互为等电子体的分子为________ (填化学式),CO分子的电子式为________ 。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________ (填化学式),CH3OH的熔、沸点比CH4高,其主要原因是_________________________________ 。
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:
(2)与CO互为等电子体的分子为
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
您最近一年使用:0次
4 . 有机物M是合成阿托伐他汀(用于治疗胆固醇等疾病)的重要中间体,其合成路线如下图所示:

已知: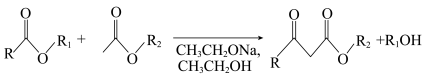
回答下列问题:
(1)A中所含官能团名称为___________ 。
(2)C中碳原子的轨道杂化类型有___________ 种。
(3)D→F的化学方程式为___________ 。
(4)在E的同分异构体中,属于酯类的物质有___________ 种;其中,核磁共振氢谱显示为4组峰,且峰面积比为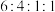 的同分异构体的结构简式为
的同分异构体的结构简式为___________ 。
(5)根据以上信息,写出以甲苯和甲醇为主要原料合成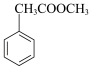 的路线(无机试剂任选)。
的路线(无机试剂任选)。___________ 。

已知:
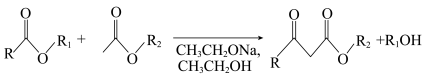
回答下列问题:
(1)A中所含官能团名称为
(2)C中碳原子的轨道杂化类型有
(3)D→F的化学方程式为
(4)在E的同分异构体中,属于酯类的物质有
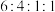 的同分异构体的结构简式为
的同分异构体的结构简式为(5)根据以上信息,写出以甲苯和甲醇为主要原料合成
 的路线(无机试剂任选)。
的路线(无机试剂任选)。
您最近一年使用:0次
解题方法
5 . 双氯芬酸钠(化合物J)是一种解热镇痛类药物,其一种合成方法如图:
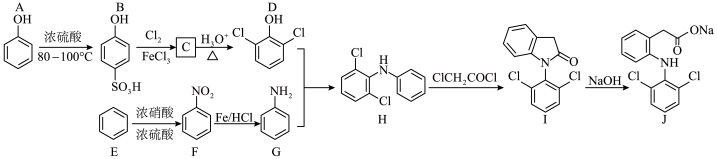
(1)A中所含的官能团名称:___________ ,D的化学名称:___________ 。
(2)C的结构简式:___________ , 的反应类型:
的反应类型:___________ 。
(3)写出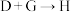 的化学方程式:
的化学方程式:___________ 。
(4)设计 和
和 两步反应的目的是
两步反应的目的是___________ 。
(5)查阅资料可知 的反应机理如下:
的反应机理如下:
①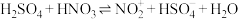
②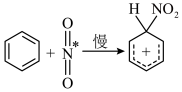
③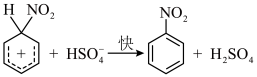
下列说法错误的是___________。
(6)写出同时符合下列条件的1的同分异构体的结构简式___________ (任写1种)
①分子中含有联苯结构(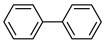 )和
)和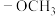 基团
基团
②核磁共振氢谱中只有4组峰

(1)A中所含的官能团名称:
(2)C的结构简式:
 的反应类型:
的反应类型:(3)写出
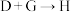 的化学方程式:
的化学方程式:(4)设计
 和
和 两步反应的目的是
两步反应的目的是(5)查阅资料可知
 的反应机理如下:
的反应机理如下:①
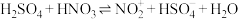
②

③

下列说法错误的是___________。
| A.反应②的活化能比反应③高 | B. 的空间结构为直线形 的空间结构为直线形 |
C.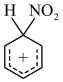 中碳原子均为 中碳原子均为 杂化 杂化 | D.浓硫酸是总反应的催化剂 |
①分子中含有联苯结构(
 )和
)和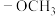 基团
基团②核磁共振氢谱中只有4组峰
您最近一年使用:0次
6 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。
I.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
① ,
,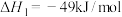
② ,
,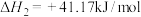
③ ,
,
(1)反应③中
___________ ,若要该反应自发进行,___________ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于反应③,下列说法中能说明该反应达到化学平衡状态的是___________(填字母序号)。
(3)在催化剂作用下,按的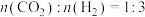 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
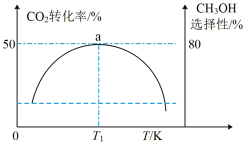
已知:甲醇的选择性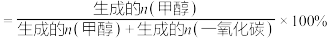
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是___________ 。
② K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,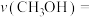
___________ 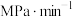 ,反应②的
,反应②的
___________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数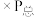 ,最终结果用分数表示)。
,最终结果用分数表示)。
II.
(4)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是___________ (填“A”或“B”),原因是___________ 。
A.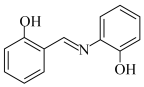 B.
B.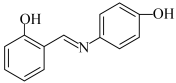
(5)吡啶(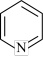 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
(6)2001年德国专家从硫酸铵中检出一种组成为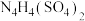 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和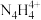 两种离子的形式存在。
两种离子的形式存在。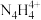 中N原子均为
中N原子均为 杂化,请写出
杂化,请写出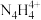 的结构式:
的结构式:___________ 。
 的转化和利用是实现碳中和的有效途径。回答下列问题。
的转化和利用是实现碳中和的有效途径。回答下列问题。I.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
 ,
,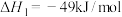
②
 ,
,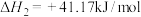
③
 ,
,
(1)反应③中

(2)在恒温,恒容密闭容器中,对于反应③,下列说法中能说明该反应达到化学平衡状态的是___________(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
C.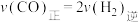 |
D.CO、 、 、 的物质的量之比为1∶2∶1 的物质的量之比为1∶2∶1 |
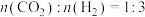 比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时
比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为6.4MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
已知:甲醇的选择性
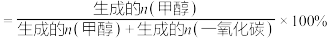
①从图中曲线的变化趋势也可以判断出反应①是放热的,判断的依据是
②
 K时,若反应从开始到达到a点所用时间为5min,
K时,若反应从开始到达到a点所用时间为5min,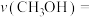
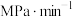 ,反应②的
,反应②的
 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数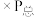 ,最终结果用分数表示)。
,最终结果用分数表示)。II.
(4)水杨醛缩邻氨基苯酚(A)又被称为“锰试剂”,可与
 形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是
形成黄色的配合物,其同分异构体水杨醛缩对氨基苯酚(B),沸点较高的是A.
 B.
B.
(5)吡啶(
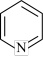 )具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。
)具有类似于苯环的平面结构,已知N原子电子云密度越大,碱性越强。下列关于吡啶的说法正确的是___________(填标号)。A.吡啶中含有与苯类似的大π键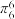 |
| B.吡啶中N原子的价层孤电子对占据2p轨道 |
C.3-甲基吡啶( )的碱性大于吡啶 )的碱性大于吡啶 |
| D.吡啶在水中的溶解度大于苯在水中的溶解度 |
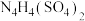 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以 和
和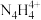 两种离子的形式存在。
两种离子的形式存在。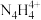 中N原子均为
中N原子均为 杂化,请写出
杂化,请写出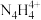 的结构式:
的结构式:
您最近一年使用:0次
名校
解题方法
7 . 中国科学家在国际上首次实现了 到淀粉的合成,不依赖植物光合作用,原料只需
到淀粉的合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。回答下列问题:
和电,相关成果发表在《科学》上。回答下列问题:
(1) 的空间结构为
的空间结构为_______ 形,其中C原子的杂化方式为_______ 。
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(3)淀粉在一定条件下可水解成葡萄糖( ),葡萄糖分子中键角
),葡萄糖分子中键角
_______ 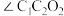 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)① 的晶胞结构如图所示:
的晶胞结构如图所示:

其中B代表 。则
。则_______ 代表 ,原子分数坐标A为(0,0,0),B为
,原子分数坐标A为(0,0,0),B为 ,则C的原子分数坐标为
,则C的原子分数坐标为_______ 。
②已知 的摩尔质量为
的摩尔质量为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。该晶胞沿体对角线方向的投影图为
。该晶胞沿体对角线方向的投影图为_______ (填选项字母)。
a. b.
b. c.
c.  d
d
 到淀粉的合成,不依赖植物光合作用,原料只需
到淀粉的合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。回答下列问题:
和电,相关成果发表在《科学》上。回答下列问题:(1)
 的空间结构为
的空间结构为(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(3)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角
),葡萄糖分子中键角
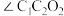 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)①
 的晶胞结构如图所示:
的晶胞结构如图所示:
其中B代表
 。则
。则 ,原子分数坐标A为(0,0,0),B为
,原子分数坐标A为(0,0,0),B为 ,则C的原子分数坐标为
,则C的原子分数坐标为②已知
 的摩尔质量为
的摩尔质量为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。该晶胞沿体对角线方向的投影图为
。该晶胞沿体对角线方向的投影图为a.
 b.
b. c.
c.  d
d
您最近一年使用:0次
2022-07-01更新
|
443次组卷
|
2卷引用:湖北省沙市中学2022-2023学年高三上学期第二次月考化学试题
解题方法
8 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
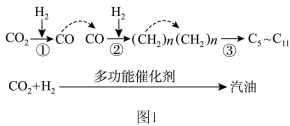
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
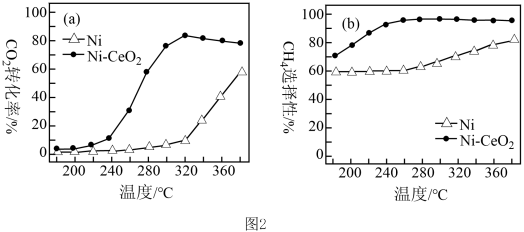
①四羰基镍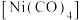 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.
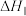
Ⅱ.
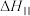
①反应

_______ 。(用含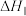 和
和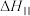 的代数式表示)
的代数式表示)
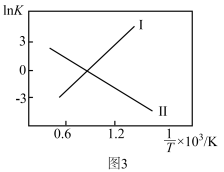
②反应Ⅰ、Ⅱ的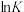 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
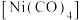 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.

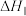
Ⅱ.

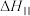
①反应


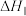 和
和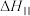 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
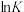 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
366次组卷
|
3卷引用:湖北省十堰市2023届高三元月调研考试化学试题
名校
解题方法
9 . 2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:____ ,其中电子占据的轨道数为_____ 个。
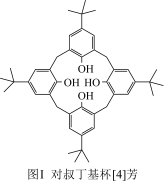
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____ ,羟基间的相互作用力为_____ 。
(3)不同大小的苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______ 。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:____ 。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于___ 晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_____ 。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为______ ,C60晶体密度的计算式为____ g·cm−3。(NA为阿伏伽德罗常数的值)
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:

(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为
(3)不同大小的苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为
您最近一年使用:0次
2019-03-25更新
|
937次组卷
|
6卷引用:【全国百强校】湖北省沙市中学2019届高三下学期能力测试(十二)理科综合化学试题
解题方法
10 . 硼和硼的化合物在工业上有着广泛的用途。
(1)基态硼原子的电子排布式为___________________________ 。
(2)晶体硼的基本结构单元是由硼原子构成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个硼原子。此结构单元中含有硼原子的数目为________________ 。

(3)氮化硼(BN)晶体有多种结构。六方氮化硼与石墨相似,具有层状结构,可作高温润滑剂。立方氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法中,正确的是____ (填标号)。

a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 B—N 键均为共价键
d.两种晶体均为分子晶体
(4)六方氮化硼晶体内硼原子的杂化方式为________ ,该晶体不导电的原因是___________ 。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。与BF4—互为等电子体的一种分子的化学式为__ , lmolNH4BF4晶体中含有配位键的数目为_____________ 。
(6)立方氮化硼的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,则立方氮化硼的一个晶胞中含有______ 个硼原子,立方氮化硼的密度是____ g•cm-3(只要求列算式,不必计算出数值,阿伏加 德罗常数为NA)。
(1)基态硼原子的电子排布式为
(2)晶体硼的基本结构单元是由硼原子构成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个硼原子。此结构单元中含有硼原子的数目为

(3)氮化硼(BN)晶体有多种结构。六方氮化硼与石墨相似,具有层状结构,可作高温润滑剂。立方氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法中,正确的是

a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 B—N 键均为共价键
d.两种晶体均为分子晶体
(4)六方氮化硼晶体内硼原子的杂化方式为
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。与BF4—互为等电子体的一种分子的化学式为
(6)立方氮化硼的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,则立方氮化硼的一个晶胞中含有
您最近一年使用:0次



