名校
解题方法
1 . 已知:红磷在氯气中燃烧可以生成两种化合物:PCl3和PCl5,PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道;PCl5分子呈三角双锥形,其结构如图1所示:

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是_______ 。
(2)下列关于PCl5分子的说法正确的有 _______。
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种 正八面体形阴离子,该晶体的晶胞如图2所示,熔体中P﹣Cl的键长只有198nm和206nm两种,这两种离子的化学式为 _______ 。

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_______ 。

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是
(2)下列关于PCl5分子的说法正确的有 _______。
| A.PCl5分子中磷原子没有孤对电子 |
| B.PCl5分子中没有形成π键 |
| C.PCl5分子中所有的Cl﹣P﹣Cl键角都相等 |
| D.SF4分子中S原子也采取sp3d杂化 |

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因
您最近一年使用:0次
解题方法
2 . 已知和氮元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y的原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是 。试回答:
。试回答:
(1)X元素的基态原子的核外电子排布式为_________ ,Y元素原子价电子排布图(也叫轨道表示式)为_________ 。
(2)X、Y两元素之间形成的化学键为_________ (填“共价键”或“离子键”)。
(3) 的空间结构为
的空间结构为_________ 形,中心原子采取_________ 杂化,分子为_________ (填“极性分子”或“非极性分子”)。
(4) 的沸点与
的沸点与 比较:
比较:_________ (填化学式)的高,原因_________ 。
 。试回答:
。试回答:(1)X元素的基态原子的核外电子排布式为
(2)X、Y两元素之间形成的化学键为
(3)
 的空间结构为
的空间结构为(4)
 的沸点与
的沸点与 比较:
比较:
您最近一年使用:0次
3 . 据报道,我国化学研究人员用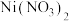 和
和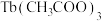 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
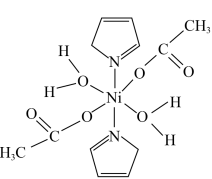
请回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 在元素周期表中的位置是
在元素周期表中的位置是_______ 。
(2)C、N、O三种元素第一电离能最大的是_______ (填元素符号)。
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为_______ 。已知: 的沸点为117.9℃,
的沸点为117.9℃,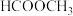 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于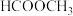 的沸点的主要原因是
的沸点的主要原因是_______ 。
(4)氧化镍的晶胞结构如图所示。若 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的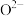 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为_______ 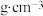 。
。

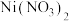 和
和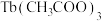 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 在元素周期表中的位置是
在元素周期表中的位置是(2)C、N、O三种元素第一电离能最大的是
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为
 的沸点为117.9℃,
的沸点为117.9℃,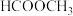 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于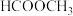 的沸点的主要原因是
的沸点的主要原因是(4)氧化镍的晶胞结构如图所示。若
 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的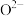 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为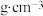 。
。
您最近一年使用:0次
4 . 钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________ 。
(2)已知第四电离能大小:I4(Fe)>I4(Co),从原子结构的角度分析可能的原因是___________ 。
(3)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
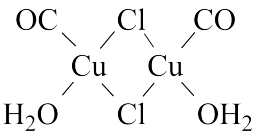
①该配合物中氯原子的杂化方式为___________ 。
②该配合物中,CO作配体时配位原子是C而不是O的原因是___________ 。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为apm,则晶体密度为___________ g/cm3
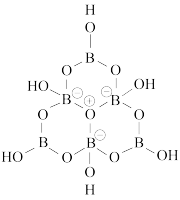
(5)基态硼原子的价电子排布图为:___________ ;科学家合成了一种含硼阴离子 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为___________ ,该结构中共有___________ 种不同化学环境的氧原子。
(1)钴元素在周期表中的位置是
(2)已知第四电离能大小:I4(Fe)>I4(Co),从原子结构的角度分析可能的原因是
(3)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:

①该配合物中氯原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为apm,则晶体密度为
(5)基态硼原子的价电子排布图为:
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
您最近一年使用:0次
解题方法
5 . C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)基态Si原子中存在___________ 种不同能量的电子。
(2)基态Ge原子核外有___________ 种不同空间运动状态的电子。
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为___________ 。硅酸盐中的硅酸根离子通常以[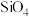 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:___________ 。

(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为___________ ,其中碳原子的杂化轨道类型为___________ 。1 mol K3[Fe(CN)6]中含有σ键与π键的数目之比为___________ 。
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则B处原子的原子分数坐标为___________ 。

(1)基态Si原子中存在
(2)基态Ge原子核外有
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为
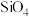 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则B处原子的原子分数坐标为

您最近一年使用:0次
解题方法
6 . 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中_______ 区; 的核外电子排布式简写为
的核外电子排布式简写为_______ 。
(2)B、C、D第一电离能由大到小为_______  用元素符号表示
用元素符号表示
(3)A和C形成的四原子分子中,中心原子的杂化方式为_______ 杂化。
(4) 分子中含有
分子中含有 键数目为
键数目为_______ 。
(5)E的单质与C的最高价氧化物水化物的稀溶液反应的离子方程式为_______ 。
| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的 倍 倍 |
| E | 位于 区且原子的最外层电子数与A的相同 区且原子的最外层电子数与A的相同 |
(1)D位于周期表中
 的核外电子排布式简写为
的核外电子排布式简写为(2)B、C、D第一电离能由大到小为
 用元素符号表示
用元素符号表示
(3)A和C形成的四原子分子中,中心原子的杂化方式为
(4)
 分子中含有
分子中含有 键数目为
键数目为(5)E的单质与C的最高价氧化物水化物的稀溶液反应的离子方程式为
您最近一年使用:0次
解题方法
7 . 完成下列问题
(1)基态铬原子的核外电子排布式为_______ ,有_______ 个未成对电子。
(2) 能形成配合物
能形成配合物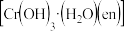 ,其中“en”代表
,其中“en”代表 。
。
①在该配合物中,提供孤电子对的原子是_______ (填元素符号)。
② “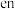 ”中采用
”中采用 杂化的原子是
杂化的原子是_______ (填元素符号)。
③在该配合物中,短周期元素按电负性由大到小的排列顺序为_______ (填元素符号)。
(3) 晶体的熔点为
晶体的熔点为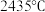 ,而
,而 晶体易升华,其主要原因是
晶体易升华,其主要原因是_______ 。
(4) 晶胞结构示意图。已知
晶胞结构示意图。已知 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为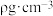 ,晶胞体积为
,晶胞体积为 。则:
。则:
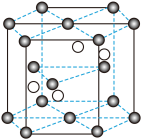
①晶胞结构示意图中的“小黑球”代表_______ (填“铬离子”或“氧离子”),1个晶胞中平均含有小黑球的个数是_______ 个。
②阿伏加德罗常数NA=_____ mol-1(用含 、
、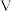 、
、 的代数式表示)。
的代数式表示)。
(1)基态铬原子的核外电子排布式为
(2)
 能形成配合物
能形成配合物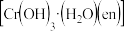 ,其中“en”代表
,其中“en”代表 。
。①在该配合物中,提供孤电子对的原子是
② “
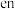 ”中采用
”中采用 杂化的原子是
杂化的原子是③在该配合物中,短周期元素按电负性由大到小的排列顺序为
(3)
 晶体的熔点为
晶体的熔点为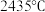 ,而
,而 晶体易升华,其主要原因是
晶体易升华,其主要原因是(4)
 晶胞结构示意图。已知
晶胞结构示意图。已知 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为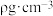 ,晶胞体积为
,晶胞体积为 。则:
。则:
①晶胞结构示意图中的“小黑球”代表
②阿伏加德罗常数NA=
 、
、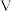 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
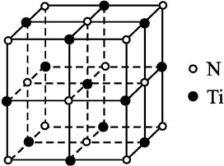
8 . 金属钛(Ti)被誉为“21世纪金属”,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图)。

图中的M是短周期金属元素,M的部分电离能如下表所示:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为___________ 。
(2)纳米TiO2是一种应用广泛的催化剂,用纳米TiO2催化的反应实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子有___________ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为___________ 。

(3)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为___________ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有___________ 个。

图中的M是短周期金属元素,M的部分电离能如下表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ·mol-1) | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为
(2)纳米TiO2是一种应用广泛的催化剂,用纳米TiO2催化的反应实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子有

(3)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为

您最近一年使用:0次
解题方法
9 . 铬的化合物应用广泛,工业上以铬铁矿(含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如下图。已知:①FeCr2O4中Cr化合价为+3;
②焙烧的目的是将FeCr2O4转化为Na2CrO4,并将Al、Si氧化物转化为可溶性钠盐。

请回答下列问题:
(1)基态铬原子的价电子排布式为___________ 。
(2)为了提高焙烧效果,可采取的一种措施是___________ 。
(3)浸取所得的滤渣为Fe2O3,由此推断FeCr2O4焙烧时发生反应的主要化学方程式为:___________ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的常用对数[1g(c/mol·L-1)]与pH的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol·L-1时,可认为已除尽,则“中和”时pH的理论范围为___________ ;“酸化”过程中的离子方程式为___________ 。

(5)三价铬离子能形成多种配位化合物, [Cr(NH3)3(H2O)2Cl]Cl,是其中一种,该配合物中心离子的配位数为___________ ;配体中分子的中心原子杂化方式为___________ 。
(6)工业上常用电解法处理含Cr2O 的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=
的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=___________ mol·L-1。(已知Ksp[Cr(OH)3]=6.0×10-31,Ksp[Fe(OH)3]可从第(4)小题图中计算得出)。
②焙烧的目的是将FeCr2O4转化为Na2CrO4,并将Al、Si氧化物转化为可溶性钠盐。

请回答下列问题:
(1)基态铬原子的价电子排布式为
(2)为了提高焙烧效果,可采取的一种措施是
(3)浸取所得的滤渣为Fe2O3,由此推断FeCr2O4焙烧时发生反应的主要化学方程式为:
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的常用对数[1g(c/mol·L-1)]与pH的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol·L-1时,可认为已除尽,则“中和”时pH的理论范围为

(5)三价铬离子能形成多种配位化合物, [Cr(NH3)3(H2O)2Cl]Cl,是其中一种,该配合物中心离子的配位数为
(6)工业上常用电解法处理含Cr2O
 的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=
的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=
您最近一年使用:0次
2022-09-09更新
|
276次组卷
|
2卷引用:湖北省“宜荆荆恩”2023届高三上学期起点考试化学试题
名校
解题方法
10 . 中国科学家在国际上首次实现了 到淀粉的合成,不依赖植物光合作用,原料只需
到淀粉的合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。回答下列问题:
和电,相关成果发表在《科学》上。回答下列问题:
(1) 的空间结构为
的空间结构为_______ 形,其中C原子的杂化方式为_______ 。
(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(3)淀粉在一定条件下可水解成葡萄糖( ),葡萄糖分子中键角
),葡萄糖分子中键角
_______ 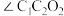 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)① 的晶胞结构如图所示:
的晶胞结构如图所示:

其中B代表 。则
。则_______ 代表 ,原子分数坐标A为(0,0,0),B为
,原子分数坐标A为(0,0,0),B为 ,则C的原子分数坐标为
,则C的原子分数坐标为_______ 。
②已知 的摩尔质量为
的摩尔质量为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。该晶胞沿体对角线方向的投影图为
。该晶胞沿体对角线方向的投影图为_______ (填选项字母)。
a. b.
b. c.
c.  d
d
 到淀粉的合成,不依赖植物光合作用,原料只需
到淀粉的合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。回答下列问题:
和电,相关成果发表在《科学》上。回答下列问题:(1)
 的空间结构为
的空间结构为(2)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(3)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角
),葡萄糖分子中键角
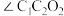 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)①
 的晶胞结构如图所示:
的晶胞结构如图所示:
其中B代表
 。则
。则 ,原子分数坐标A为(0,0,0),B为
,原子分数坐标A为(0,0,0),B为 ,则C的原子分数坐标为
,则C的原子分数坐标为②已知
 的摩尔质量为
的摩尔质量为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。该晶胞沿体对角线方向的投影图为
。该晶胞沿体对角线方向的投影图为a.
 b.
b. c.
c.  d
d
您最近一年使用:0次
2022-07-01更新
|
443次组卷
|
2卷引用:湖北省沙市中学2022-2023学年高三上学期第二次月考化学试题



