解题方法
1 . 含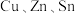 及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)写出基态 电子排布式
电子排布式___________ 。 与C均为第四主族元素,基态
与C均为第四主族元素,基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2) 的空间结构名称为
的空间结构名称为___________ , 中心原子杂化方式为
中心原子杂化方式为___________ 。非金属性氧大于硫,能证明此关系成立的一种事实为___________ 。
(3) 的配位体是
的配位体是___________ , 形成配合物后
形成配合物后 键角会
键角会___________ (填“变大”、“变小”或“不变”),原因是成键电子对之间的排斥力___________ 孤电子对与成键电子对的排斥力(填“>”、“<”或“=”)。
(4)如图是硫的四种含氧酸根的结构:
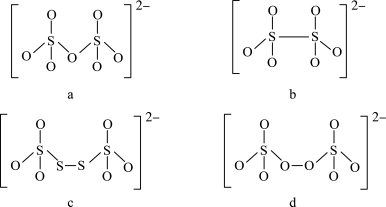
根据组成和结构推断,能在酸性溶液中将 转化为
转化为 的是
的是___________ (填序号),写出其离子反应方程式___________ 。
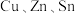 及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:(1)写出基态
 电子排布式
电子排布式 与C均为第四主族元素,基态
与C均为第四主族元素,基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为(2)
 的空间结构名称为
的空间结构名称为 中心原子杂化方式为
中心原子杂化方式为(3)
 的配位体是
的配位体是 形成配合物后
形成配合物后 键角会
键角会(4)如图是硫的四种含氧酸根的结构:

根据组成和结构推断,能在酸性溶液中将
 转化为
转化为 的是
的是
您最近一年使用:0次
名校
解题方法
2 . 某小组进行如下“简单配合物的形成”的实验活动。
实验用品:试管、胶头滴管: 、
、 、
、 、
、 、蒸馏水、乙醇;
、蒸馏水、乙醇; 的
的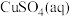 、
、 氨水。
氨水。
按要求回答下列问题。
(1)分别取下表中粉末少量于点滴板各孔穴中,加入足量蒸馏水溶解,对比观察现象,填写表中空白:
(2)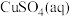 与氨水反应的实验
与氨水反应的实验
①向盛有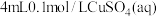 的试管中滴入几滴
的试管中滴入几滴 氨水实验现象为
氨水实验现象为_________ ;写出该反应的离子方程式:________________ 。
②继续加入氨水,得到深蓝色透明溶液。写出该反应的离子方程式:__________________ 。
③再加入乙醇,观察到析出深蓝色晶体。写出该晶体的化学式:__________________ 。
④经结构测定实验证明,步骤②中的深蓝色的配离子中:中心离子为_________ ,配位数为_________ ,配体为_________ 。
实验用品:试管、胶头滴管:
 、
、 、
、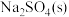 、
、 、蒸馏水、乙醇;
、蒸馏水、乙醇; 的
的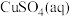 、
、 氨水。
氨水。按要求回答下列问题。
(1)分别取下表中粉末少量于点滴板各孔穴中,加入足量蒸馏水溶解,对比观察现象,填写表中空白:
固体物质 |  |  | 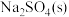 |  |
粉末颜色 | 白色 | 深褐色 | 白色 | 白色 |
溶液颜色 | 天蓝色 | 无色 | ||
实验结论 | ①溶液中呈无色的主要离子有 | |||
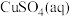 与氨水反应的实验
与氨水反应的实验①向盛有
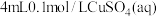 的试管中滴入几滴
的试管中滴入几滴 氨水实验现象为
氨水实验现象为②继续加入氨水,得到深蓝色透明溶液。写出该反应的离子方程式:
③再加入乙醇,观察到析出深蓝色晶体。写出该晶体的化学式:
④经结构测定实验证明,步骤②中的深蓝色的配离子中:中心离子为
您最近一年使用:0次
2023-05-02更新
|
247次组卷
|
2卷引用:天津市河西区2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
3 . 金属材料对于促进生产发展、改善人类生活发挥了巨大作用。
I.钢是人类使用最早的金属之一,至今仍被广泛应用于电气、电子等领域。
(1)写出基态Cu原子的核外电子排布式___________ 。涩法冶炼是以赤铜矿( )精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
)精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
(2)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为___ 。
(3)已知: 晶胞为立方体形,边长为
晶胞为立方体形,边长为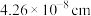 。根据图示,每个
。根据图示,每个 晶胞中含O原子的数目为
晶胞中含O原子的数目为___________ 个。计算 晶体的密度
晶体的密度
___________  (结果保留两位小数)。
(结果保留两位小数)。
(4)基态Na原子的价层电子轨道表示式为___________ 。
(5)NaCl熔点为:800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为:
 ,加入
,加入 的目的是
的目的是___________ 。
(6)除去 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是___________ 。
Ⅲ.钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(7) 原子的价电子排布式为
原子的价电子排布式为 ,它在元素周期表中的位置是
,它在元素周期表中的位置是___________ 。
(8) 易与
易与 形成
形成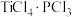 。下列关于
。下列关于 分子说法错误的是___________。
分子说法错误的是___________。
(9)钛溶于盐酸制得的三氯化钛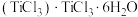 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、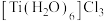 (紫色),两者配位数
(紫色),两者配位数___________ (选填“相同”或“不同”),绿色晶体中配体是___________ 。
I.钢是人类使用最早的金属之一,至今仍被广泛应用于电气、电子等领域。
(1)写出基态Cu原子的核外电子排布式
 )精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
)精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。(2)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为
(3)已知:
 晶胞为立方体形,边长为
晶胞为立方体形,边长为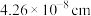 。根据图示,每个
。根据图示,每个 晶胞中含O原子的数目为
晶胞中含O原子的数目为 晶体的密度
晶体的密度
 (结果保留两位小数)。
(结果保留两位小数)。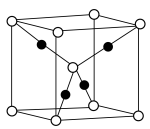
(4)基态Na原子的价层电子轨道表示式为
(5)NaCl熔点为:800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为:

 ,加入
,加入 的目的是
的目的是(6)除去
 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是Ⅲ.钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(7)
 原子的价电子排布式为
原子的价电子排布式为 ,它在元素周期表中的位置是
,它在元素周期表中的位置是(8)
 易与
易与 形成
形成 。下列关于
。下列关于 分子说法错误的是___________。
分子说法错误的是___________。| A.键角为120° | B.是极性分子 |
C.含有 键 键 | D.中心原子采取 杂化 杂化 |
(9)钛溶于盐酸制得的三氯化钛
 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、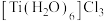 (紫色),两者配位数
(紫色),两者配位数
您最近一年使用:0次
2024-04-07更新
|
305次组卷
|
3卷引用:天津市红桥区2024届高三一模化学试题
名校
解题方法
4 . 已知:2[Co(H2O)6]2++10NH3+2NH +H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的
+H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的
 +H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的
+H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的| A.NH3和H2O的中心原子的杂化类型相同 |
| B.反应中H2O2作氧化剂,发生还原反应,被还原 |
| C.NH3和H2O与Co3+的配位能力:NH3 < H2O |
| D.1mol[Co(H2O)6]2+配离子中,含有的σ键数目为18×6.02×1023 |
您最近一年使用:0次
5 . 血红蛋白可与 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为
②
下列说法中错误的是
 结合,更易与
结合,更易与 配位,血红蛋白与
配位,血红蛋白与 配位示意如图所示。血红蛋白
配位示意如图所示。血红蛋白 与
与 、
、 结合的反应可表示为
结合的反应可表示为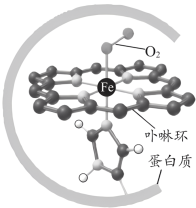

②

下列说法中错误的是
A.相同温度下, | B.反应①②的 、 、 均小于0 均小于0 |
C.图中 的配位数为6 的配位数为6 | D.用高压氧舱治疗 中毒时,平衡①②均逆向移动 中毒时,平衡①②均逆向移动 |
您最近一年使用:0次
2024-01-13更新
|
1150次组卷
|
7卷引用:天津市红桥区2024届高三下学期二模化学试题
天津市红桥区2024届高三下学期二模化学试题辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题江西省宜春市丰城市第九中学2023-2024学年高三上学期期末考试化学试题
名校
解题方法
6 . 请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子核外电子的运动状态有_________ 种。
(2)高纯硅制备过程中会有 、
、 等中间产物生成。
等中间产物生成。
沸点:
_________  (填“>”或“<”);
(填“>”或“<”);
已知电负性:H>Si, 充分水解会生成两种酸和一种气体,写出该反应的化学方程式为
充分水解会生成两种酸和一种气体,写出该反应的化学方程式为______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为:[ ],下列说法错误的是
],下列说法错误的是_________ (填字母标号)。
A. 中σ键与π键数目之比为5:2
中σ键与π键数目之比为5:2
B.Mn原子的配位数为6
C. 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(4)FePO4是一种锂离子电池的正极材料,放电时生成LiFePO4。
①下列电子排布图表示的Li原子的状态中,能量最高的为_________ (填序号)。
a.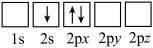 b.
b.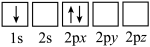
c.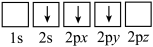
②锂离子电池充放电过程中,正极材料晶胞的组成变化如图所示。
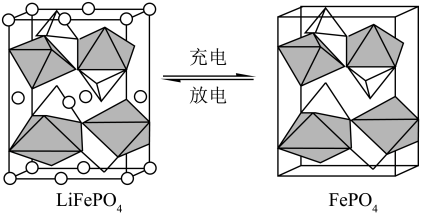
 的空间构型为
的空间构型为_________ 。正极材料在 和
和 之间转化时,每摩尔晶胞转移电子的物质的量为
之间转化时,每摩尔晶胞转移电子的物质的量为___________ mol。
(1)5G芯片主要材质是高纯硅。基态Si原子核外电子的运动状态有
(2)高纯硅制备过程中会有
 、
、 等中间产物生成。
等中间产物生成。沸点:

 (填“>”或“<”);
(填“>”或“<”);已知电负性:H>Si,
 充分水解会生成两种酸和一种气体,写出该反应的化学方程式为
充分水解会生成两种酸和一种气体,写出该反应的化学方程式为(3)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为:[
 ],下列说法错误的是
],下列说法错误的是A.
 中σ键与π键数目之比为5:2
中σ键与π键数目之比为5:2B.Mn原子的配位数为6
C.
 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(4)FePO4是一种锂离子电池的正极材料,放电时生成LiFePO4。
①下列电子排布图表示的Li原子的状态中,能量最高的为
a.
 b.
b.
c.

②锂离子电池充放电过程中,正极材料晶胞的组成变化如图所示。

 的空间构型为
的空间构型为 和
和 之间转化时,每摩尔晶胞转移电子的物质的量为
之间转化时,每摩尔晶胞转移电子的物质的量为
您最近一年使用:0次
7 . 下列有关说法正确的是
A.Na2O和Na2O2固体中阳离子和阴离子个数比都是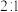 |
| B.CO2和SiO2的化学键类型和晶体类型相同 |
C. 和NH3都可以做为配合物的配体 和NH3都可以做为配合物的配体 |
| D.Al和N的原子轨道都有3个单电子 |
您最近一年使用:0次
8 . 关于 溶液,下列说法不正确的是
溶液,下列说法不正确的是
 溶液,下列说法不正确的是
溶液,下列说法不正确的是A. 中S原子的杂化方式为 中S原子的杂化方式为 |
B. 组成元素中电负性最大的是N元素 组成元素中电负性最大的是N元素 |
C. 所含有的化学键有离子键、极性共价键和配位键 所含有的化学键有离子键、极性共价键和配位键 |
D. 中,N原子是配位原子 中,N原子是配位原子 |
您最近一年使用:0次
9 . 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时发生的反应为 。生成物K2S的晶体结构如图。下列有关说法正确的是
。生成物K2S的晶体结构如图。下列有关说法正确的是

 。生成物K2S的晶体结构如图。下列有关说法正确的是
。生成物K2S的晶体结构如图。下列有关说法正确的是
| A.反应产物中有两种极性分子 |
| B.1molCO2和1molN2含有的π键数目之比为1:2 |
| C.K2S晶体中阴、阳离子的配位数分别为4和8 |
D.若K2S晶体的晶胞边长为a nm,则该晶体的密度为 g·cm-3 g·cm-3 |
您最近一年使用:0次
2023-03-16更新
|
261次组卷
|
2卷引用:天津市第三中学2022-2023学年高二下学期3月阶段性质量检测化学试题
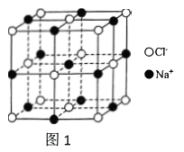
10 . Ⅰ.氯化钠是一种典型且极具魅力的晶体,我们通过学习氯化钠可以更好地了解其他类似物质的结构。已知氯化钠的晶胞如图1所示。___________ 。
(2)已知NaCl的密度为 ,NaCl的摩尔质量为
,NaCl的摩尔质量为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在NaCl晶体里
,则在NaCl晶体里 和
和 的最短距离为
的最短距离为___________ pm。
(3)下列关于氯化钠的说法不正确的是___________。
(4)用离子方程式表示氯碱工业反应原理___________ 。
Ⅱ.我国某研究所于2022年研制出一种新型离子液体[CPMIm]Cl(如图2)可弥补该电池表面的 和
和 缺陷,进一步提高该电池的性能。
缺陷,进一步提高该电池的性能。___________ (填选项字母)。
A.离子键 B.共价键 C.氢键
(6)离子液体[CPMIm]Cl中不同杂化方式的碳原子个数比: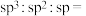
___________ 。
(7)相较于传统液态有机溶剂,该离子液体具有难挥发的优点,原因是:___________ 。
(2)已知NaCl的密度为
 ,NaCl的摩尔质量为
,NaCl的摩尔质量为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在NaCl晶体里
,则在NaCl晶体里 和
和 的最短距离为
的最短距离为(3)下列关于氯化钠的说法不正确的是___________。
A.基态 的电子有5种空间运动状态 的电子有5种空间运动状态 |
B.第三周期离子半径最大的是 |
C.第三电离能大小: |
| D.每个氯离子周围与它最近且等距的氯离子有12个 |
Ⅱ.我国某研究所于2022年研制出一种新型离子液体[CPMIm]Cl(如图2)可弥补该电池表面的
 和
和 缺陷,进一步提高该电池的性能。
缺陷,进一步提高该电池的性能。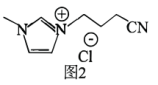
A.离子键 B.共价键 C.氢键
(6)离子液体[CPMIm]Cl中不同杂化方式的碳原子个数比:
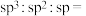
(7)相较于传统液态有机溶剂,该离子液体具有难挥发的优点,原因是:
您最近一年使用:0次



