1 . 钒、钨、锌在工业上用途广泛。
(1)基态钒(V)元素在周期表中的位置为_______ ,其最高化合价为_______ ,与其同周期且未成对电子数相同的元素符号为_______ ;
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
则X的配离子为_______ ,Y的配体为_______ 。
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为_______ 色。

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到_______ 个钨原子。
②计算晶胞的空间利用率_______ (写出表达式,不计算具体数值)。
(1)基态钒(V)元素在周期表中的位置为
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
| 原溶液 | X溶液 | X溶液 | Y溶液 | Y溶液 |
| 所加试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到
②计算晶胞的空间利用率
您最近一年使用:0次
名校
2 . 铬、铁、钴、铜等金属及其化合物在工业上有重要用途。请回答:
(1)基态铬原子的价电子排布图为 (填序号)。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述描述中涉及的非金属元素电负性由大到小的顺序是__________ (填序号)。
A.C>Cl>O B.C<Cl<O C.O>Cl>C D.C<O<Cl
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于_____ 晶体。
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配合物的化学式应该写为__________ (填序号)。
A.[Cr(H2O)4Cl] Cl2·2H2O B.[Cr(H2O)4Cl2] Cl·2H2O
C.[Cr(H2O)4Cl2] Cl D.[Cr(H2O)3Cl3]·H2O
(3)Co3+与NO 形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
①配体 的立体构型为
的立体构型为__________ (填序号)。
A. 三角锥形 B. 平面三角形 C.直线形 D.V形
② 的中心原子的杂化类型为
的中心原子的杂化类型为__________ (填序号)。
A. sp B. sp2 C.sp3 D.dsp2
③N原子中有_______ 种能量不同的电子。
(4)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。

化学式为_____ 。该晶胞中只由铁原子构成的晶胞堆积模型为__________ 。若两个最近的Fe原子间的距离为a nm,则该晶体的密度是______________ (填序号)g/cm3(设阿伏加德罗常数的值为NA)。
A. B.
B. ×1030 C.
×1030 C. ×
× ×1027 D.
×1027 D.  ×1021
×1021
(5)如上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是棱心和__________ 。
(1)基态铬原子的价电子排布图为 (填序号)。
A. | B. |
C.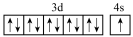 | D. |
①上述描述中涉及的非金属元素电负性由大到小的顺序是
A.C>Cl>O B.C<Cl<O C.O>Cl>C D.C<O<Cl
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配合物的化学式应该写为
A.[Cr(H2O)4Cl] Cl2·2H2O B.[Cr(H2O)4Cl2] Cl·2H2O
C.[Cr(H2O)4Cl2] Cl D.[Cr(H2O)3Cl3]·H2O
(3)Co3+与NO
 形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。①配体
 的立体构型为
的立体构型为A. 三角锥形 B. 平面三角形 C.直线形 D.V形
②
 的中心原子的杂化类型为
的中心原子的杂化类型为A. sp B. sp2 C.sp3 D.dsp2
③N原子中有
(4)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。

化学式为
A.
 B.
B. ×1030 C.
×1030 C. ×
× ×1027 D.
×1027 D.  ×1021
×1021(5)如上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是棱心和
您最近一年使用:0次
解题方法
3 . Fe、Ni均为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)基态Fe原子的原子结构示意图为______ ,依据电子排布特点,铁属于元素周期表中______ 区元素。
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。
①(H2NCH2COO)2Fe中含有的第二周期元素的第一电离能由大到小的顺序为______ 。
②甘氨酸(H2NCH2COOH)的沸点比相同相对分子质量的烷烃高很多,原因是_____ 。
(3)FeO、NiO的晶胞结构和NaCl相同。
①已知离子半径r(Fe2+)>r(Ni2+),则熔点FeO______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图,Fe2+的配位数为_____ 。

③FeO在氧气中加热,部分Fe2+被氧化为Fe3+。晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为apm,密度为ρg•cm-3,则x=______ (填写计算表达式)。
(1)基态Fe原子的原子结构示意图为
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。
①(H2NCH2COO)2Fe中含有的第二周期元素的第一电离能由大到小的顺序为
②甘氨酸(H2NCH2COOH)的沸点比相同相对分子质量的烷烃高很多,原因是
(3)FeO、NiO的晶胞结构和NaCl相同。
①已知离子半径r(Fe2+)>r(Ni2+),则熔点FeO
②FeO晶胞如图,Fe2+的配位数为

③FeO在氧气中加热,部分Fe2+被氧化为Fe3+。晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为apm,密度为ρg•cm-3,则x=
您最近一年使用:0次
名校
解题方法
4 . 氮的相关化合物在材料等方面有重要用途。回答下列问题:
(1)基态N原子的核外电子排布式为_______ ,第一电离能: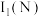
_______ 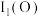 (填“大于”或“小于”)。
(填“大于”或“小于”)。
(2)N及其同族的P、As均可形成类似的氢化物, 、
、 ,
, 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______ (填化学式)。
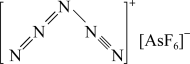
(3)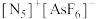 是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为_______ 。
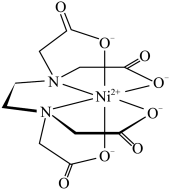
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有_______ 个,其中提供孤对电子的原子为_______ (写元素符号)。
(5)钴的一种化合物的晶胞结构如下图所示:

①已知A点的原子坐标参数为(0,0,0),B点为 ,则C点的原子坐标参数为
,则C点的原子坐标参数为_______ 。
②已知晶胞参数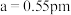 ,则该晶体的密度为
,则该晶体的密度为_______  (用
(用 表示阿伏加德罗常数,只列出计算表达式即可。)
表示阿伏加德罗常数,只列出计算表达式即可。)
(1)基态N原子的核外电子排布式为
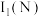
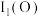 (填“大于”或“小于”)。
(填“大于”或“小于”)。(2)N及其同族的P、As均可形成类似的氢化物,
 、
、 ,
, 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)
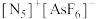 是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
(5)钴的一种化合物的晶胞结构如下图所示:

①已知A点的原子坐标参数为(0,0,0),B点为
 ,则C点的原子坐标参数为
,则C点的原子坐标参数为②已知晶胞参数
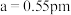 ,则该晶体的密度为
,则该晶体的密度为 (用
(用 表示阿伏加德罗常数,只列出计算表达式即可。)
表示阿伏加德罗常数,只列出计算表达式即可。)
您最近一年使用:0次
名校
解题方法
5 . Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态 的价层电子轨道表达式为
的价层电子轨道表达式为_______ ,C、N、O的第一电离能从小到大的顺序为_______ 。
(2)N、P可形成一些复杂离子,如 、
、 、
、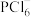 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
(3)Fe、Ni易与CO形成配合物, 中σ键与π键个数比为
中σ键与π键个数比为_______ , 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为_______ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO_______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图, 的配位数为
的配位数为_______ 。

(1)基态
 的价层电子轨道表达式为
的价层电子轨道表达式为(2)N、P可形成一些复杂离子,如
 、
、 、
、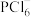 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为 的空间构型为
的空间构型为(3)Fe、Ni易与CO形成配合物,
 中σ键与π键个数比为
中σ键与π键个数比为 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO
②FeO晶胞如图,
 的配位数为
的配位数为
您最近一年使用:0次
解题方法
6 . 三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂,在有机工业上有广泛的用途。常用以下方法制备:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2 + 3O2↑+ 40CH3COOH。
请回答下列问题:
(1)三醋酸锰[(CH3COO)3Mn]中阳离子的最外层轨道表示式为_______ 。
(2)CH3COOH的电离方程式是_______ 。
(3) 的空间结构是
的空间结构是_______ ,1 mol醋酸酐[(CH3CO)2O]中所含σ键数与π键数之比为_______ 。
(4)过渡元素锰能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如图所示。
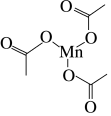
分析Mn和O之间能形成配位键的原因_______ 。
(5)Mn2+能形成配离子为八面体的配合物MnClm·nNH3,在该配合物的配离子中,Mn2+位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示NH3分子或Cl-):
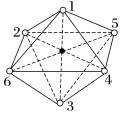
若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1 mol AgCl沉淀,该配合物的化学式为_______ 。
(6)锰与硒形成的某种化合物具有优异的光电性能,其晶胞结构如下图所示。

①则该化合物的化学式为_______ 。
②若该晶体的晶胞边长为a pm(1 pm=10-10cm),阿伏加德罗常数的值为NA,则该晶体的密度为_______  (列出表达式即可)。
(列出表达式即可)。
请回答下列问题:
(1)三醋酸锰[(CH3COO)3Mn]中阳离子的最外层轨道表示式为
(2)CH3COOH的电离方程式是
(3)
 的空间结构是
的空间结构是(4)过渡元素锰能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如图所示。

分析Mn和O之间能形成配位键的原因
(5)Mn2+能形成配离子为八面体的配合物MnClm·nNH3,在该配合物的配离子中,Mn2+位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示NH3分子或Cl-):

若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1 mol AgCl沉淀,该配合物的化学式为
(6)锰与硒形成的某种化合物具有优异的光电性能,其晶胞结构如下图所示。

①则该化合物的化学式为
②若该晶体的晶胞边长为a pm(1 pm=10-10cm),阿伏加德罗常数的值为NA,则该晶体的密度为
 (列出表达式即可)。
(列出表达式即可)。
您最近一年使用:0次
解题方法
7 . 氮元素与氢元素能形成多种化合物,在工业、农业和国防等方面用途非常广泛,例如:氨气、肼(N2H4)、叠氮酸(HN3)……等,请回答下列问题:
(1)N位于周期表中____ 区,基态N原子的价电子排布式为____ 。
(2)N2H4分子的电子式为____ ,其中N采取____ 杂化。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式____ ;叠氮化物易与过渡金属元素形成配合物,如:[Fe(N3)(NH3)5]SO4,在该配合物中Fe的配位数为____ ,SO 的立体构型为
的立体构型为____ 。
(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为____ 。
(5)氮与铝形成的某种晶体的晶胞如图所示。
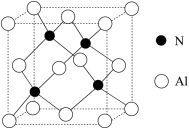
①该晶体的化学式为____ 。
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率____ (用含a、b、d和NA的式子表示)。
(1)N位于周期表中
(2)N2H4分子的电子式为
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N
 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式 的立体构型为
的立体构型为(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为
(5)氮与铝形成的某种晶体的晶胞如图所示。

①该晶体的化学式为
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率
您最近一年使用:0次
解题方法
8 . 铜及其化合物的用途非常广泛。回答下列问题:
(1)实验室常用新制的 来检验醛基,反应原理为
来检验醛基,反应原理为 。
。
①基态铜原子的价电子排布式为___________ ,Cu成为阳离子时首先失去___________ 轨道上的电子。
② 中的中心原子的杂化轨道类型为
中的中心原子的杂化轨道类型为___________ ,HCHO分子中 键与
键与 键的个数之比为
键的个数之比为___________ 。
③上述反应中涉及的非金属元素的电负性由大到小的顺序为___________ (填元素符号)。
(2)黄铜矿(主要成分为 )是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为
)是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为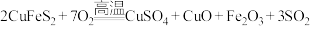 。
。
① 的空间结构为
的空间结构为___________ 。
② 中的中心原子S上的孤电子对数为
中的中心原子S上的孤电子对数为___________ 。
(3)磷化铜(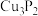 )用于制造磷青铜,某磷青铜的晶胞结构如图所示。
)用于制造磷青铜,某磷青铜的晶胞结构如图所示。

①该晶体中距离Cu原子最近的Cu原子有___________ 个。
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为___________ (用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值) 。
。
(1)实验室常用新制的
 来检验醛基,反应原理为
来检验醛基,反应原理为 。
。①基态铜原子的价电子排布式为
②
 中的中心原子的杂化轨道类型为
中的中心原子的杂化轨道类型为 键与
键与 键的个数之比为
键的个数之比为③上述反应中涉及的非金属元素的电负性由大到小的顺序为
(2)黄铜矿(主要成分为
 )是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为
)是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为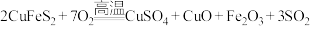 。
。①
 的空间结构为
的空间结构为②
 中的中心原子S上的孤电子对数为
中的中心原子S上的孤电子对数为(3)磷化铜(
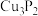 )用于制造磷青铜,某磷青铜的晶胞结构如图所示。
)用于制造磷青铜,某磷青铜的晶胞结构如图所示。
①该晶体中距离Cu原子最近的Cu原子有
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为
 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值) 。
。
您最近一年使用:0次
解题方法
9 . 砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是____ 。
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。
已知:AsCl3和InCl3均为分子晶体,AsCl3气化室的温度为130℃,InCl3气化室的温度为500℃。
①AsCl3分子的空间结构为____ ,中心原子As的杂化轨道类型为____ 。
②AsCl3气化室温度低于InCl3气化室温度的原因是____ 。
③InCl3晶体中分子间存在配位键,配位原子是____ 。
(3)InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。

①一个晶胞中所含As的个数为____ 。
②已知该晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA,InAs的摩尔质量为Mg•mol-1,则该晶体的密度ρ=____ g•cm-3。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。
已知:AsCl3和InCl3均为分子晶体,AsCl3气化室的温度为130℃,InCl3气化室的温度为500℃。
①AsCl3分子的空间结构为
②AsCl3气化室温度低于InCl3气化室温度的原因是
③InCl3晶体中分子间存在配位键,配位原子是
(3)InAs为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。

①一个晶胞中所含As的个数为
②已知该晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA,InAs的摩尔质量为Mg•mol-1,则该晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
10 . 卤族元素及其化合物种类繁多,有着非常重要的用途。回答下列问题:
(1)基态Br原子的电子排布式为[Ar]_______ 。
(2)HF分子的极性_______ (填“大于”、“等于”或“小于”,以下同)HCl,同一条件下,HF在水中的溶解度_______ HCl,HF的沸点_______ HCl。SOCl2中心S原子VSEPR模型为_______ 。1mol氟硼酸铵(NH4BF4)中含有_______ mol配位键。
(3)下列对IF3分子的空间结构推断最合理的是_______ (填标号)(已知:电子对之间的最小夹角为90°时,排斥力最小的更稳定)。
A. B.
B.  C.
C. 
(4)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,坐标原点见图,标记为n的原子分数坐标为 ,则m的原子分数坐标为
,则m的原子分数坐标为_______ ,距离Hg最近的Ag有_______ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为M g•mol-1,该晶体的密度为_______ g·cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)HF分子的极性
(3)下列对IF3分子的空间结构推断最合理的是
A.
 B.
B.  C.
C. 
(4)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,坐标原点见图,标记为n的原子分数坐标为
 ,则m的原子分数坐标为
,则m的原子分数坐标为
您最近一年使用:0次



