名校
解题方法
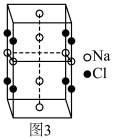
1 . 过渡金属元素铬( )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)请写出基态铬( )原子价电子的轨道表示式
)原子价电子的轨道表示式___________ 。
(2)超分子的定义是广义的,包括离子。一种羟甲基酚钠盐形成的含铁超分子的化学式为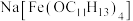 ,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:
,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:___________ 。
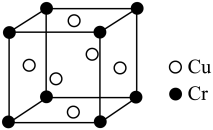
(3)某铜铬合金的立方晶胞结构如图所示。该铜铬合金的化学式为___________ ;离 原子最近的
原子最近的 原子数目为
原子数目为___________ ,离 原子最近的
原子最近的 原子数目为
原子数目为___________ 。若该晶胞参数为apm,则该晶体的密度为___________ 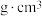 。
。___________ 种。其同主族元素Si可形成硅酸盐,下图中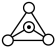 表示硅氧四面体,则该硅酸盐结构的通式为
表示硅氧四面体,则该硅酸盐结构的通式为___________ 。
 )是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)请写出基态铬(
 )原子价电子的轨道表示式
)原子价电子的轨道表示式(2)超分子的定义是广义的,包括离子。一种羟甲基酚钠盐形成的含铁超分子的化学式为
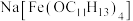 ,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:
,已知羟甲基酚属于杯酚,请写出该含铁超分子的一种特性:(3)某铜铬合金的立方晶胞结构如图所示。该铜铬合金的化学式为
 原子最近的
原子最近的 原子数目为
原子数目为 原子最近的
原子最近的 原子数目为
原子数目为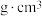 。
。
 表示硅氧四面体,则该硅酸盐结构的通式为
表示硅氧四面体,则该硅酸盐结构的通式为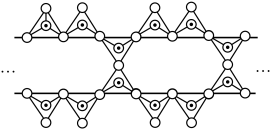
您最近一年使用:0次
解题方法
2 . 双钙钛矿型氧化物通过掺杂改性可用作固体电解质材料。某该型晶体的完整结构单元如图所示,掺杂改性后的晶体中存在5%的O空位缺陷。下列说法错误的是

| A.Ni原子与Mn原子的配位数相等 |
| B.O空位的形成有利于O2-的传导 |
| C.完整结构时,该晶体的化学式为La2MnNiO6 |
| D.掺杂改性后,该晶体中La3+与La4+的个数比为1:4 |
您最近一年使用:0次
3 . 元素及其化合物因其结构的差异导致性质各异。请回答:
(1)某激发态磷原子的电子排布式为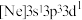 ,该磷原子中有
,该磷原子中有_______ 种空间运动状态不同的电子。
(2)NCl3的空间结构为_______ ,和BCl3相比二者中沸点更高的物质是______ ,原因是_______ 。第一电离能介于B、N之间的第二周期元素有_______ 种。
(3)N、P位于同一主族,但 间的夹角比
间的夹角比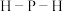 间的大,其主要原因是
间的大,其主要原因是_______ 。
(4)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图。_______ 个。
②FeS2的摩尔质量为120g∙mol-1,阿伏加德罗常数为NA。该晶体的密度为_______ g∙cm-3。
(1)某激发态磷原子的电子排布式为
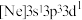 ,该磷原子中有
,该磷原子中有(2)NCl3的空间结构为
(3)N、P位于同一主族,但
 间的夹角比
间的夹角比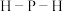 间的大,其主要原因是
间的大,其主要原因是(4)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图。
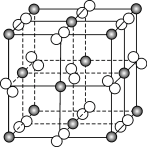
②FeS2的摩尔质量为120g∙mol-1,阿伏加德罗常数为NA。该晶体的密度为
您最近一年使用:0次
4 . 新型钙钛矿材料可用于太阳能电池。一种钙钛矿晶体由Sn2+、I-和有机阳离子( )构成,其立方晶胞结构如图所示。下列说法错误的是
)构成,其立方晶胞结构如图所示。下列说法错误的是
 )构成,其立方晶胞结构如图所示。下列说法错误的是
)构成,其立方晶胞结构如图所示。下列说法错误的是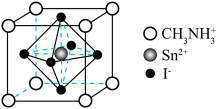
| A.晶体的最简化学式为CH3NH3SnI3 | B.基态碘原子的价层电子排布式为5s25p5 |
| C.晶体中Sn2+的配位数是8 | D.晶胞中Sn2+和I-构成的是正八面体 |
您最近一年使用:0次
2024-04-15更新
|
265次组卷
|
3卷引用:2024届贵州省高三下学期二模化学试题
5 . 回答下列问题
(1)铜的氢化物晶体的一种结构如图1所示,写出此氢化物在氯气中燃烧的化学方程式____________ ;____________ ;_________ ; 的原因是
的原因是____________ ;
(5)活性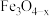 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示.根据元素电负性的变化规律,如图所示的反应步骤I可描述为
的催化剂,其可能反应机理如图所示.根据元素电负性的变化规律,如图所示的反应步骤I可描述为____________ 。
(1)铜的氢化物晶体的一种结构如图1所示,写出此氢化物在氯气中燃烧的化学方程式
 的原因是
的原因是(5)活性
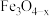 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示.根据元素电负性的变化规律,如图所示的反应步骤I可描述为
的催化剂,其可能反应机理如图所示.根据元素电负性的变化规律,如图所示的反应步骤I可描述为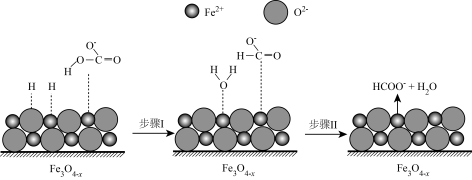
您最近一年使用:0次
名校
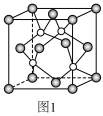
6 . 将铁粉在NH3和H2的混合气氛中加热,可得含Fe和N的磁性材料,其晶体的晶胞如下图,晶胞边长均为apm。下列说法不正确 的是
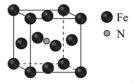
| A.距离N最近的Fe有6个 |
B.Fe之间的最近距离为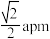 |
C.该晶体的密度为 g·cm-3 g·cm-3 |
| D.若将N置于晶胞顶点,则Fe位于体心和棱心 |
您最近一年使用:0次
2024-04-13更新
|
556次组卷
|
3卷引用:2023-2024学年海淀区第二学期期中考试高三化学试卷
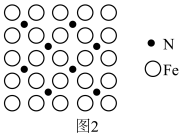
7 . 现有一种由正离子An+、Bm+和负离子X—组成的无机固体电解质,该物质在高温相为无序结构,低温相为有序结构,两者的结构如图,下列说法错误的是
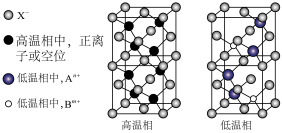
| A.n=2,m=1 | B.高温相中X—的堆积方式和氯化钠中Cl—的堆积方式相同 |
| C.低温相中An+的配位数为4 | D.高温相的良好导电性与其结构中存在大量的空位有关 |
您最近一年使用:0次
2024-04-13更新
|
731次组卷
|
4卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷
名校
解题方法
8 . 镧镍合金是一种储氢材料,其晶胞可认为由两种结构不同的层交替堆积而成,如下图所示,该合金的密度为p g·cm-3.已知该合金的晶胞中最多可容纳9个氢原子。下列叙述错误的是
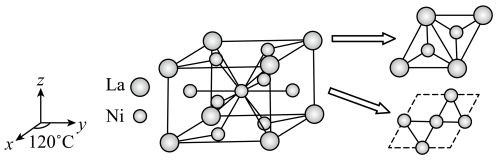
| A.基态Ni原子的价电子排布式为3d84s2 |
| B.该合金的化学式为LaNi5 |
C.设La的原子坐标为(0,0,0),则晶胞底面上Ni的原子坐标为系( , ,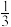 ,0)或( ,0)或( , , ,0) ,0) |
D.假定吸氢后体积不变,则合金中氢的最大密度为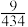 ρg·cm-3 ρg·cm-3 |
您最近一年使用:0次
2024-04-13更新
|
734次组卷
|
5卷引用:河北省石家庄市2024届高三下学期4月第二次质检化学试题
河北省石家庄市2024届高三下学期4月第二次质检化学试题(已下线)化学(新七省高考“15+4”)-2024年高考押题预测卷河北省重点高中2023-2024学年高三5月高考模拟化学试题(一)(已下线)选择题11-142024届江西省宜春市宜丰中学高三下学期模拟预测化学试题
名校
解题方法
9 . 元素化学是化学的基石,不同的元素往往呈现出五彩缤纷的特性。回答下列问题:
(1) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ ,还原性由强到弱的顺序为___________ 。
(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:___________ 。
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
(4)已知 ,
, 的N原子杂化方式为
的N原子杂化方式为___________ ;比较键角 :
: 中的
中的
___________  中的
中的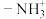 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由___________ 。
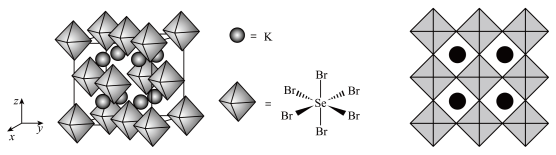
(5) 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是___________ ;___________ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是__________。
A. | B.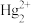 | C. | D. |
(4)已知
 ,
, 的N原子杂化方式为
的N原子杂化方式为 :
: 中的
中的
 中的
中的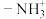 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),请说明理由
”),请说明理由(5)
 的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个
的晶体结构可以看成Ⅰ型结构和Ⅱ型结构的组合,已知Ⅰ型结构中As原子在内部,每个Ⅰ型和Ⅱ型结构可近似为边长相等的立方体。一个 的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
的晶胞中Ⅰ型结构和Ⅱ型结构的比例是
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则化合物X中相邻K之间的最短距离为
,则化合物X中相邻K之间的最短距离为 )。
)。
您最近一年使用:0次
名校
解题方法
10 . [W10Ox]y的结构如图所示,下列说法不正确的是

A.结构中基本单元化学式为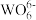 |
| B.[W10Ox]y中,x=32,y=4- |
| C.它属于同多酸类离子 |
| D.基本单元结构为八面体,其中有6个氧原子共顶点 |
您最近一年使用:0次



