1 . 有很多固体,气体化合物的内部组成结构都是晶体,某科学小组研究晶体的相关性质,阿伏伽德罗常数用NA表示。_______ 。
A.冰分子内部有共价键,所以冰是分子晶体
B.冰分子之间产生分子间作用力,所以冰是分子晶体
C.一种化合物只能形成一种晶体结构
(2)如上图所示晶胞对应的化学式为_____ ,如果A代表Cl,B代表H,X代表O,晶胞的参数为acm,则此时晶胞的密度为_____ ,并写出其与H2S的离子方程式_______ 。(提示,会产生一种会造成酸雨的气体),若反应产生1344mL的气体(标准情况下),则转移了_____ 个电子。

A.冰分子内部有共价键,所以冰是分子晶体
B.冰分子之间产生分子间作用力,所以冰是分子晶体
C.一种化合物只能形成一种晶体结构
(2)如上图所示晶胞对应的化学式为
您最近一年使用:0次
解题方法
2 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为___________ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是___________ 。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒___________ (分子或离子);
②硫氰酸分子中硫原子的杂化方式为___________ 。
③异硫氰酸的沸点比硫氰酸沸点高的原因是___________ 。
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为___________ pm(列出计算式即可)。

(1)基态铁原子价电子排布式为
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒
②硫氰酸分子中硫原子的杂化方式为
③异硫氰酸的沸点比硫氰酸沸点高的原因是
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为

您最近一年使用:0次
名校
3 . 回答下列问题
(1)元素铜的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________ 。

(2) 为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子6个位于面心和8个位于顶点,则该晶胞中有
为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子6个位于面心和8个位于顶点,则该晶胞中有___________ 个铜原子。
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为___________ ,该功能陶瓷的化学式为___________ 。

(4)某晶体结构模型如图所示。在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为___________ 、___________ 。

(1)元素铜的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

(2)
 为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子6个位于面心和8个位于顶点,则该晶胞中有
为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子6个位于面心和8个位于顶点,则该晶胞中有(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为

(4)某晶体结构模型如图所示。在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为

您最近一年使用:0次
名校
4 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯 与四氟乙烯
与四氟乙烯 的共聚物(ETFE)制成。回答下列问题:
的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______ 。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ ;第三电离能的变化图是_______ (填标号)。

(3)氟化氢的沸点高于氯化氢的原因是_______ 。
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
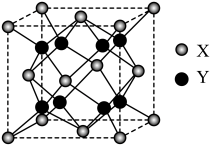
(5)萤石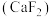 是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______ ;若该立方晶胞参数为a pm,正负离子的核间距最小为_______ pm。
 与四氟乙烯
与四氟乙烯 的共聚物(ETFE)制成。回答下列问题:
的共聚物(ETFE)制成。回答下列问题:(1)基态F原子的价电子排布图(轨道表示式)为
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(3)氟化氢的沸点高于氯化氢的原因是
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因
(5)萤石
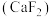 是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
您最近一年使用:0次
名校
解题方法
5 . 化学,让生活更美好。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
①基态 核外电子的空间运动状态有
核外电子的空间运动状态有__________ 种。
②乳酸分子中 键与
键与 键的数目比为
键的数目比为__________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为__________ 。
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有__________ 种不同化学环境的C原子。
②研究发现,适量硒酸钠 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小:
__________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是__________ 。
(3) 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。

①抗坏血酸的分子式是__________ , 的价层电子轨道表示式为
的价层电子轨道表示式为__________ 。
②下列说法中不正确 的是__________ 。
A.抗坏血酸分子中碳原子的轨道杂化类型为
B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D. 在水溶液中以
在水溶液中以 形式存在,
形式存在, 的配位原子为
的配位原子为
③ 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
__________  。
。
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①基态
 核外电子的空间运动状态有
核外电子的空间运动状态有②乳酸分子中
 键与
键与 键的数目比为
键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有
②研究发现,适量硒酸钠
 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小:
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是(3)
 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。
①抗坏血酸的分子式是
 的价层电子轨道表示式为
的价层电子轨道表示式为②下列说法中
A.抗坏血酸分子中碳原子的轨道杂化类型为

B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D.
 在水溶液中以
在水溶液中以 形式存在,
形式存在, 的配位原子为
的配位原子为
③
 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
 。
。
您最近一年使用:0次
名校
解题方法
6 . 我国科学家构建了新型催化剂“纳米片” ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为_______ ,N、C、Co中第一电离能最大的是_______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用_______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为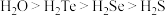 ,其原因是
,其原因是_______ 。
(3)氰 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为_______ 。
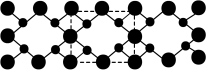
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为_______ 。
 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用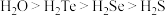 ,其原因是
,其原因是(3)氰
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为

您最近一年使用:0次
2024-01-01更新
|
188次组卷
|
3卷引用:山东省菏泽市东明县第一中学2023-2024学年高二下学期开学化学试题
名校
7 . Ⅰ.硒—钴—镧La 三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
(1)钴位于元素周期表中_____ (填“s”、“p”、“d”或“ds”)区,与钴位于同一周期且含有相同未成对电子数的元素有_____ 种。
(2)元素Se 、O、N 的第一电离能由大到小的顺序_____ 。
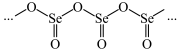
硒的某种氧化物为链状聚合结构如图所示,该氧化物的化学式为_____ 。
(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。
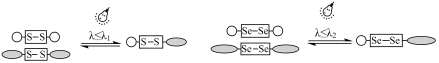
已知光的波长与键能成反比,则图中实现光响应的波长: λ1_________ λ 2 (填“>”、“<”或“=”),其原因是_____ 。
Ⅱ.
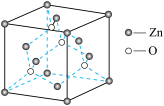
(4)ZnO 的晶胞结构如下图,则 Zn2+的配位数为_____ ;已知晶胞参数为 a cm,该晶体的密度为_____ g cm-3(写出计算式,阿伏加德罗常数的值为 NA)。
(1)钴位于元素周期表中
(2)元素Se 、O、N 的第一电离能由大到小的顺序
硒的某种氧化物为链状聚合结构如图所示,该氧化物的化学式为

(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长: λ1
Ⅱ.
(4)ZnO 的晶胞结构如下图,则 Zn2+的配位数为

您最近一年使用:0次
解题方法
8 . 石油开采和炼制过程中产生的污水含有溶解性的 以及难溶的硫化物,对污水进行处理的同时可回收化工原料。已知:
以及难溶的硫化物,对污水进行处理的同时可回收化工原料。已知: 在水中溶解度为1∶2.6,易挥发。回答下列问题:
在水中溶解度为1∶2.6,易挥发。回答下列问题:
(1)沉淀法处理含硫废水:
向含硫废水中加入适量 的溶液,产生黑色沉淀且溶液的pH降低。解释溶液的pH降低的原因:
的溶液,产生黑色沉淀且溶液的pH降低。解释溶液的pH降低的原因:___________ 。
(2)氧化还原法处理含硫废水:
①空气氧化法可将含硫微粒氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
②向废水中加入一定浓度的 溶液,加酸将溶液调为
溶液,加酸将溶液调为 ,产生淡黄色沉淀。反应的离子方程式为
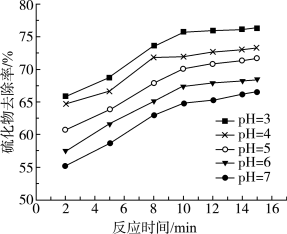
,产生淡黄色沉淀。反应的离子方程式为___________ 。不同pH时,硫化物去除率随时间的变化曲线如下图。选择控制体系的 ,不选择
,不选择 ,从环境保护的角度来分析其主要原因:
,从环境保护的角度来分析其主要原因:___________ 。
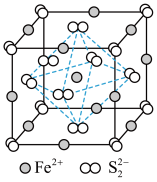
(3) 晶体的晶胞如图所示。晶胞边长为anm,设阿伏加德罗常数的值为
晶体的晶胞如图所示。晶胞边长为anm,设阿伏加德罗常数的值为 。
。 的配位数为
的配位数为___________ ,其晶体密度为___________  ;晶胞中
;晶胞中 位于
位于 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为___________ nm。
 以及难溶的硫化物,对污水进行处理的同时可回收化工原料。已知:
以及难溶的硫化物,对污水进行处理的同时可回收化工原料。已知: 在水中溶解度为1∶2.6,易挥发。回答下列问题:
在水中溶解度为1∶2.6,易挥发。回答下列问题:(1)沉淀法处理含硫废水:
向含硫废水中加入适量
 的溶液,产生黑色沉淀且溶液的pH降低。解释溶液的pH降低的原因:
的溶液,产生黑色沉淀且溶液的pH降低。解释溶液的pH降低的原因:(2)氧化还原法处理含硫废水:
①空气氧化法可将含硫微粒氧化为
 ,反应的离子方程式为
,反应的离子方程式为②向废水中加入一定浓度的
 溶液,加酸将溶液调为
溶液,加酸将溶液调为 ,产生淡黄色沉淀。反应的离子方程式为
,产生淡黄色沉淀。反应的离子方程式为 ,不选择
,不选择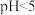 ,从环境保护的角度来分析其主要原因:
,从环境保护的角度来分析其主要原因:
(3)
 晶体的晶胞如图所示。晶胞边长为anm,设阿伏加德罗常数的值为
晶体的晶胞如图所示。晶胞边长为anm,设阿伏加德罗常数的值为 。
。 的配位数为
的配位数为 ;晶胞中
;晶胞中 位于
位于 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
9 . 铝及其化合物在生产和科研中有广泛的应用。回答下列问题:
(1)Al位于元素周期表的_____ 区;基态Al原子价层电子的轨道表示式为_____ 。
(2) 是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测
是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测 的熔点比
的熔点比
_____ (填“高”或“低”),原因是_____ 。
(3) 溶解在
溶解在 溶液中可形成
溶液中可形成 (四羟基合铝酸钠)溶液,在
(四羟基合铝酸钠)溶液,在 溶液中存在的化学键有_____(填字母)。
溶液中存在的化学键有_____(填字母)。
(4)近年来,人们发现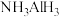 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,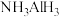 与HF形成的双氢键可表示为
与HF形成的双氢键可表示为_____ 。
(5)Al单质晶体中原子的堆积方式与干冰中 分子的相同,其晶胞如图所示。
分子的相同,其晶胞如图所示。
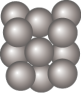
①在该晶体中,一个Al原子周围距离最近的Al原子有_____ 个。
②若晶胞参数为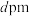 ,
, 表示阿伏伽德罗常数的值,Al单质的密度可表示为
表示阿伏伽德罗常数的值,Al单质的密度可表示为_____  (用含d和
(用含d和 代数式表示)。
代数式表示)。
(1)Al位于元素周期表的
(2)
 是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测
是一种应用广泛的新型无机非金属材料,其结构与晶体硅类似,由此推测 的熔点比
的熔点比
(3)
 溶解在
溶解在 溶液中可形成
溶液中可形成 (四羟基合铝酸钠)溶液,在
(四羟基合铝酸钠)溶液,在 溶液中存在的化学键有_____(填字母)。
溶液中存在的化学键有_____(填字母)。| A.离子键 | B.极性键 | C.非极性键 | D.配位键 | E.金属键 |
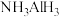 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。根据上述信息,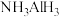 与HF形成的双氢键可表示为
与HF形成的双氢键可表示为| X—H…H—Y (“—”表示共价键,“…”表示形成的双氢键) |
 分子的相同,其晶胞如图所示。
分子的相同,其晶胞如图所示。
①在该晶体中,一个Al原子周围距离最近的Al原子有
②若晶胞参数为
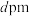 ,
, 表示阿伏伽德罗常数的值,Al单质的密度可表示为
表示阿伏伽德罗常数的值,Al单质的密度可表示为 (用含d和
(用含d和 代数式表示)。
代数式表示)。
您最近一年使用:0次
2023-08-15更新
|
186次组卷
|
2卷引用:江西省宜春市丰城拖船中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
10 . 我国力争在2030年前实现“碳达峰”。2060年前实现“碳中和”的目标,因此二氧化碳的固定及转化成了重要的研究课题。
Ⅰ.在 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;
Ⅱ.新型 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。
请回答下列问题:
(1)基态Cu原子的外围电子排布式为___________ ,基态O原子核外有___________ 种不同运动状态的电子。
(2)Ⅰ中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ (填化学式)。
(3) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子中含有的 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 反应中,
反应中, 的立体构型为
的立体构型为___________ , 的沸点高于
的沸点高于 的原因是
的原因是___________ 。
(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。
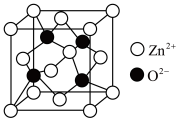
① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为___________ 。
②设晶胞边长为anm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  。
。
Ⅰ.在
 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。请回答下列问题:
(1)基态Cu原子的外围电子排布式为
(2)Ⅰ中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(3)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 键和
键和 键数目之比为
键数目之比为(4)
 反应中,
反应中, 的立体构型为
的立体构型为 的沸点高于
的沸点高于 的原因是
的原因是(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。

①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为anm,
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近一年使用:0次
2023-07-30更新
|
935次组卷
|
4卷引用:江西省吉安市宁冈中学2023-2024学年高三上学期开学考试化学试题



