21-22高二下·全国·单元测试
解题方法
1 . 金属晶体
(1)在金属晶体中,原子间以_____________ 相结合。
(2)金属晶体的性质:优良的_____________ 、_____________ 和_____________ 。
(1)在金属晶体中,原子间以
(2)金属晶体的性质:优良的
您最近一年使用:0次
名校
2 . I.有下列8种晶体,用序号回答下列问题:
A.水晶B.冰醋酸C.白磷D.固态氩E.氯化铵F.铝G.金刚石
(1)属于原子晶体的化合物是____ ,属于离子晶体的是____ ,不含化学键的分子晶体是____ 。
(2)由极性分子构成的晶体是____ ,含有共价键的离子晶体是____ 。
II.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(3)Cu+基态核外电子排布式为____ 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为____ 。
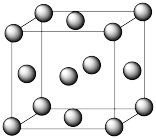
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为_____ 。
III.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(6)SO 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为_____ ;NO 的空间构型为
的空间构型为_____ (用文字描述)。
(7)与O3分子互为等电子体的一种阴离子为_____ (填化学式)。
(8)N2分子中σ键与π键的数目比n(σ)∶n(π)=_____ 。
A.水晶B.冰醋酸C.白磷D.固态氩E.氯化铵F.铝G.金刚石
(1)属于原子晶体的化合物是
(2)由极性分子构成的晶体是
II.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(3)Cu+基态核外电子排布式为
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为

III.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(6)SO
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(7)与O3分子互为等电子体的一种阴离子为
(8)N2分子中σ键与π键的数目比n(σ)∶n(π)=
您最近一年使用:0次
名校
3 . 铜及其化合物在工农业生产中有广泛的应用。
Ⅰ.金属铜的原子堆积模型如图-1所示,
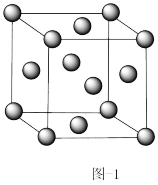
(1)该晶胞中每个Cu原子周围最近距离的Cu原子数目为_______ 。
Ⅱ. 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。
(2)向 溶液中加入过量NaOH溶液可生成
溶液中加入过量NaOH溶液可生成 。
。 中除了配位键外,还存在的化学键类型有_______(填字母)。
中除了配位键外,还存在的化学键类型有_______(填字母)。
(3)将CuO投入 、
、 的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为
的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为 溶液。
溶液。
①CuO被浸取的离子方程式为_______ 。
② 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的化合物,由此推测
分子,可以得到两种不同结构的化合物,由此推测 的空间构型为
的空间构型为_______ 。
(4) 可以与乙二胺(
可以与乙二胺(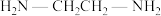 )形成配离子,如题图-2所示:
)形成配离子,如题图-2所示:
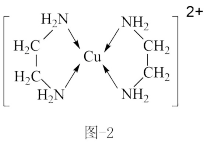
③H、O、N三种元素的电负性从大到小的顺序为_______ 。
④乙二胺分子中N原子成键时采取的杂化类型是_______ 。乙二胺和三甲胺 均属于胺,但乙二胺比三甲胺的沸点高很多,原因是
均属于胺,但乙二胺比三甲胺的沸点高很多,原因是_______ 。
Ⅲ.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,
(5)下列物质中,属于顺磁性物质的是_______ (填标号)。
A. B.
B. C.
C.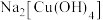
Ⅰ.金属铜的原子堆积模型如图-1所示,

(1)该晶胞中每个Cu原子周围最近距离的Cu原子数目为
Ⅱ.
 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。(2)向
 溶液中加入过量NaOH溶液可生成
溶液中加入过量NaOH溶液可生成 。
。 中除了配位键外,还存在的化学键类型有_______(填字母)。
中除了配位键外,还存在的化学键类型有_______(填字母)。| A.离子键 | B.金属键 | C.极性共价键 | D.非极性共价键 |
 、
、 的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为
的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为 溶液。
溶液。①CuO被浸取的离子方程式为
②
 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的化合物,由此推测
分子,可以得到两种不同结构的化合物,由此推测 的空间构型为
的空间构型为(4)
 可以与乙二胺(
可以与乙二胺(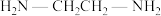 )形成配离子,如题图-2所示:
)形成配离子,如题图-2所示: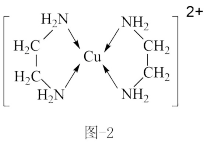
③H、O、N三种元素的电负性从大到小的顺序为
④乙二胺分子中N原子成键时采取的杂化类型是
 均属于胺,但乙二胺比三甲胺的沸点高很多,原因是
均属于胺,但乙二胺比三甲胺的沸点高很多,原因是Ⅲ.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,
(5)下列物质中,属于顺磁性物质的是
A.
 B.
B. C.
C.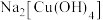
您最近一年使用:0次
2022-11-11更新
|
1366次组卷
|
4卷引用:江苏省苏州市2022-2023学年高二上学期期中调研化学试卷
名校
解题方法
4 . 几种离子晶体的晶胞如图所示,下列说法正确的是
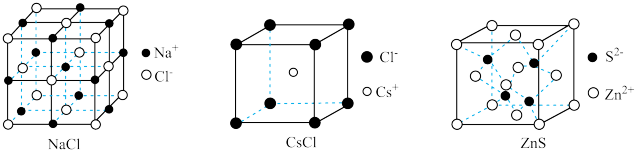

| A.熔沸点:NaCl<CsCl |
B.NaCl晶胞中, 做面心立方最密堆积, 做面心立方最密堆积,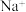 填充正四面体空隙 填充正四面体空隙 |
C.若ZnS的晶胞边长为a pm,则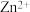 与 与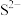 之间的最近距离为 之间的最近距离为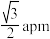 |
| D.上述三种晶胞中,阳离子的配位数:ZnS<NaCl<CsCl |
您最近一年使用:0次
2022高三·全国·专题练习
5 . 锂、铁单质晶胞分别如图、图所示,锂、铁晶胞的配位数之比为_______ 。




您最近一年使用:0次
名校
6 . 在照相底片定影时,Na2S2O3溶液能溶解未起反应的AgBr,这是因为Ag+与S2O 生成配离子,Ag+的配位数为2。下列说法不正确的是
生成配离子,Ag+的配位数为2。下列说法不正确的是

 生成配离子,Ag+的配位数为2。下列说法不正确的是
生成配离子,Ag+的配位数为2。下列说法不正确的是
A.Ag+与S2O 结合成配离子,使反应AgBr(s) 结合成配离子,使反应AgBr(s) Ag+(aq)+Br-(aq)平衡向右移动 Ag+(aq)+Br-(aq)平衡向右移动 |
| B.上述反应生成配合物的化学方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr |
C.Ag+与S2O 反应时,Ag+提供空轨道,S2O 反应时,Ag+提供空轨道,S2O 提供孤电子对,二者通过配位键结合 提供孤电子对,二者通过配位键结合 |
| D.如图为单质银的晶胞(面心立方最密堆积),银原子的配位数为6 |
您最近一年使用:0次
7 . 回答下列问题:
(1)钌(Ru)基催化剂在低温下活性高,工业上常用该催化剂替代铁系催化剂催化合成氨,以RuCl3/SiO2为模板制备钌基催化剂及催化合成氨过程如图所示,请回答下列问题。
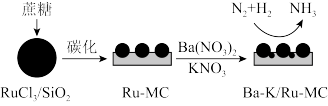
Ru在Fe的下一周期且与Fe同族。
①Ru在元素周期表中的位置为____ 。
②一个基态Fe2+和Fe3+未成对电子数之比为____ 。
③NH3的键角____ (填“大于”或“小于”)PH3,其原因为____ 。
④NO 有多种等电子体,其中和NO
有多种等电子体,其中和NO 互为等电子体的分子有
互为等电子体的分子有___ 。
⑤多原子分子中,若原子都在同一平面上,且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π元键可用π 表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO
表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO 的大π元键可表示为
的大π元键可表示为___ 。
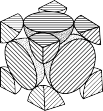
(2)经X射线衍射测定发现,晶体钻在417℃以上堆积方式的剖面图如图所示,则晶体钴堆积方式为____ ,钴原子的配位数是____ ,若该堆积方式下的晶胞参数为acm,(阿伏加德罗常数为NA),则钴原子的半径为___ pm。
(1)钌(Ru)基催化剂在低温下活性高,工业上常用该催化剂替代铁系催化剂催化合成氨,以RuCl3/SiO2为模板制备钌基催化剂及催化合成氨过程如图所示,请回答下列问题。
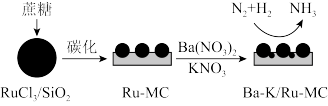
Ru在Fe的下一周期且与Fe同族。
①Ru在元素周期表中的位置为
②一个基态Fe2+和Fe3+未成对电子数之比为
③NH3的键角
④NO
 有多种等电子体,其中和NO
有多种等电子体,其中和NO 互为等电子体的分子有
互为等电子体的分子有⑤多原子分子中,若原子都在同一平面上,且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π元键可用π
 表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO
表示,其中m、n分别代表参与形成大π元键的原子个数和电子个数,则NO 的大π元键可表示为
的大π元键可表示为(2)经X射线衍射测定发现,晶体钻在417℃以上堆积方式的剖面图如图所示,则晶体钴堆积方式为

您最近一年使用:0次
8 . 下列说法正确的是
A. 和 和 两种晶体中, 两种晶体中, 的晶格能大 的晶格能大 |
| B.任何晶体中,若含有阳离子也一定含有阴离子 |
| C.固态不导电,熔融状态下能导电的晶体不一定是离子晶体 |
| D.分子的形状、极性以及分子之间是否存在氢键等,都会影响分子的堆积方式 |
您最近一年使用:0次
名校
9 . 已知X、Y、Z、W、Q是原子序数依次增大的前四周期元素。X原子核外有6种不同运动状态的电子;Y基态原子中s电子总数与p电子总数相等;Z最高价氧化物对应水化物的碱性在同周期元素中最强;W基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反。
(1)基态X原子中电子占据的最高能级的原子轨道形状为_______ 。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为_______ 。
(2)Y、Z、W的简单离子半径由大到小的顺序为_______ 。(用离子符号表示)
(3)Q是生活中使用最广泛的一种金属。
①Q的原子结构示意图为_______ 。
②检验溶液中是否含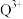 离子的试剂是
离子的试剂是_______ (填化学式),现象为_______ 。
③Q的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_______ (填字母序号)。
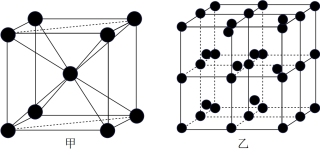
A.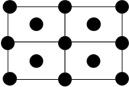 B.
B.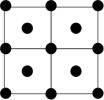 C.
C.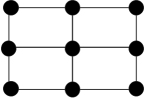 D.
D.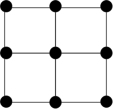
(1)基态X原子中电子占据的最高能级的原子轨道形状为
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态X原子,其核外电子自旋磁量子数的代数和为(2)Y、Z、W的简单离子半径由大到小的顺序为
(3)Q是生活中使用最广泛的一种金属。
①Q的原子结构示意图为
②检验溶液中是否含
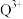 离子的试剂是
离子的试剂是③Q的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是

A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
10 . 磷元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的P中,电离最外层一个电子所需能量最小的是_______(填标号)。
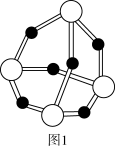
(2)白磷在空气中缓慢氧化生成P4O6,P4O6的结构如图1所示。P4O6中氧原子的杂化轨道类型为_______ ,每个P4O6分子中含孤电子对的数目为_______ 。
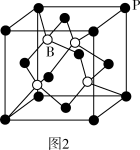
(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。在一个晶胞中磷原子空间堆积方式为_______ ,磷原子的配位数为_______ 。
(4)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为_______ 。
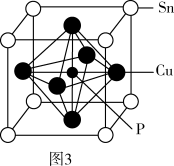
(5)磷青铜晶体的晶胞结构如图3所示,该晶体中P原子位于由铜原子形成的_______ 的空隙中。若晶体密度为ag·cm-3,P原子与最近的Cu原子的核间距为_______ nm(用含NA的代数式表示,NA为阿伏加德罗常数的值)。
(1)下列状态的P中,电离最外层一个电子所需能量最小的是_______(填标号)。
A.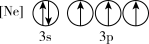 | B.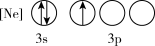 |
C.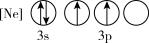 | D.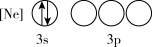 |

(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。在一个晶胞中磷原子空间堆积方式为

(4)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(5)磷青铜晶体的晶胞结构如图3所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次



