名校
1 . 明矾[KAl(SO4) 2·12H2O]易溶于水,不易溶于乙醇,在生产、生活中有广泛用途。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量的SiO2、FeO·xFe2O2)制备明矾的工艺流程如下:
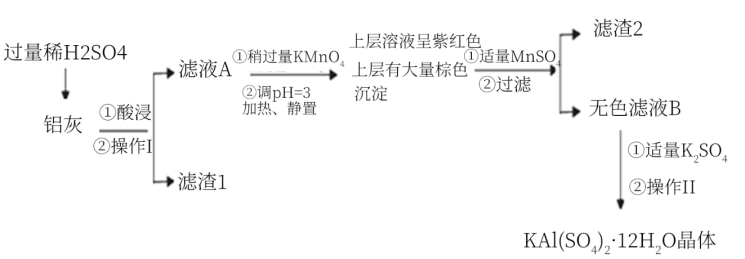
回答下列问题:
(1)酸浸时为提高铝的浸取虑,可采取的措施是_________ (填标号)。
a 改用同浓度的硝酸 b 用硫酸多次浸取 c 浸取时间缩短一半 d 适当升高温度
(2)滤渣1的成分是__________ ;滤渣2经过处理可以制得一种高效的无机高分子混凝剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________ 。
(3)检验滤液A中含有Fe2+的实验方案及现象是________________________________________ 。
(4)已知常温下Ksp[Fe(OH)3]=4.0×10-38,当调节溶液的pH=3时,溶液中c(Fe3+)=____________ 。
(5)操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,使用酒精洗涤明矾晶体的目的是______ ;明矾净水的原理是__________________ (写离子方程式)。
(6)已知在pH=3和加热条件下,MnO4-可与Mn2+反应生成MnO2,则上述流程图中加入适量MnSO4发生反应的离子方程式为_________________________ 。

回答下列问题:
(1)酸浸时为提高铝的浸取虑,可采取的措施是
a 改用同浓度的硝酸 b 用硫酸多次浸取 c 浸取时间缩短一半 d 适当升高温度
(2)滤渣1的成分是
(3)检验滤液A中含有Fe2+的实验方案及现象是
(4)已知常温下Ksp[Fe(OH)3]=4.0×10-38,当调节溶液的pH=3时,溶液中c(Fe3+)=
(5)操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,使用酒精洗涤明矾晶体的目的是
(6)已知在pH=3和加热条件下,MnO4-可与Mn2+反应生成MnO2,则上述流程图中加入适量MnSO4发生反应的离子方程式为
您最近一年使用:0次
2017-10-16更新
|
328次组卷
|
2卷引用:广西梧州柳州2018届高三毕业班摸底调研考试理综化学试题
解题方法
2 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体。回答下列问题:

(1)在空气中直接加热CuCl2·2H2O晶体得不到纯净的无水CuCl2的原因是___________________ (用化学方程式表示)。
(2)仪器a的名称是____________ ,锥形瓶中得到的物质x的化学式为______________ 。
(3)碱石灰中含有CaO和NaOH,NaOH的电子式为__________ ,碱石灰的作用是______________ 。
(4)三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是_______________________ 。
(5)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取 0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O32-=S4O42-+2I-)。
①滴定到终点时的现象是_____________________________________ 。
②该试样中铜元素的百分含量为__________ 。

(1)在空气中直接加热CuCl2·2H2O晶体得不到纯净的无水CuCl2的原因是
(2)仪器a的名称是
(3)碱石灰中含有CaO和NaOH,NaOH的电子式为
(4)三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是
(5)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取 0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O32-=S4O42-+2I-)。
①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
解题方法
3 . 利用钻渣[含Co(OH)2、Fe2O3、Al2O3、MnO等)可以来制取钻的氧化物和CoCl2·6H2O,工艺流程如图所示:
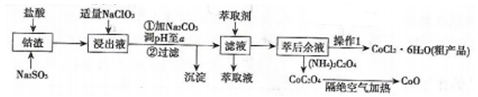
①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为________ 。
(2)流程中加入适量的NaClO3的作用是___________ 。若加入NaClO3过量,可能产生有毒气体,写出生成该有毒气体的离子方程式___________________ 。
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是___________ 。沉淀的主要成分是______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是________ ;其使用的最佳pH范围是________ 。
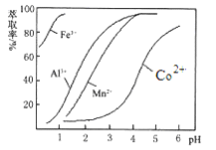
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是______ 、______ 和过滤。
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为_______________ 。

①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为
(2)流程中加入适量的NaClO3的作用是
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是

A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为
您最近一年使用:0次
2017-10-06更新
|
379次组卷
|
2卷引用:广西钦州市2018届高三上学期第一次质量检测理综化学试题1
名校
4 . 工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe均为中等活泼金属)的工艺流程如图所示:
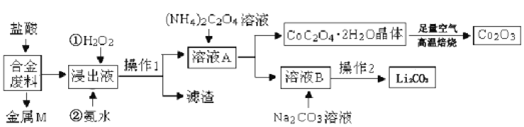
问答下列问题:
(l)(NH4)2C2O4中C元素的化合价为________ 。
(2)合金废料加入盐酸浸取,该盐酸不能换为硝酸,原因是____________ 。
残渣M的主要成分是一种金属单质,该金属为_______________ ,
(3)“浸出液”中先后加入的两种试剂涉及氨水、H2O2溶液,应先加入____________ ,加入氨水发生反应的离+方程式为____________________ 。
(4)溶液A中的金属阳离子是_________ ,加入(NH4)2C2O4溶液的目的是__________ 。
(5)“操作1”的名称是_________ ,草酸钴高温焙烧生成Co2O3,实验室中高温焙烧使用的仪器是_____ (填字)。
a.蒸发皿b.表面皿c.烧杯d.坩埚
(6)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。“操作2”中,蒸发浓缩后必须趁热过滤,其目的是_________________ ,90℃时Ksp(Li2CO3)的值为___________ 。

问答下列问题:
(l)(NH4)2C2O4中C元素的化合价为
(2)合金废料加入盐酸浸取,该盐酸不能换为硝酸,原因是
残渣M的主要成分是一种金属单质,该金属为
(3)“浸出液”中先后加入的两种试剂涉及氨水、H2O2溶液,应先加入
(4)溶液A中的金属阳离子是
(5)“操作1”的名称是
a.蒸发皿b.表面皿c.烧杯d.坩埚
(6)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。“操作2”中,蒸发浓缩后必须趁热过滤,其目的是
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
您最近一年使用:0次
2017-09-25更新
|
449次组卷
|
4卷引用:广西桂林市柳州市2018届高三综合模拟金卷(1)理综化学试题
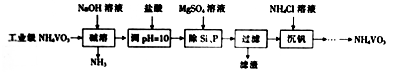
5 . 偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
(1)碱溶时,下列措施有利于NH3逸出的是_____ (填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5。若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________ 。
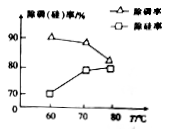
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______ ;但随着温度的升高,除硅率升高,其原因是______ (用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______ 。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______ mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器测定沉钒率。加入蒸馏水的目的是______ 。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________ 。
(1)碱溶时,下列措施有利于NH3逸出的是
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5。若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为
您最近一年使用:0次
2017-03-24更新
|
548次组卷
|
3卷引用:广西南宁市2017届高三第一次模拟测试理综化学试题
广西南宁市2017届高三第一次模拟测试理综化学试题2017届广西钦州市高三下学期普通高中毕业班第一次适应性测试(二模)理综化学试卷(已下线)广西钦州市普通高中2017届高三下学期第一次适应性测试(二模)理综化学试题
解题方法
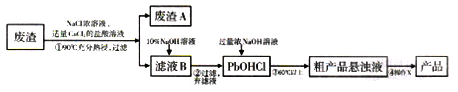
6 . PbO主要用做电子管、显像管、光学玻璃和防X射线的铅玻璃的原料,它是一种难溶于水,密度较大的固体。下图是用某工业废渣(含PbSO435%,其余为CaSO4)生产PbO的主要流程。
已知:从液体中分离出密度较大且不溶的固体常用倾析法,即先使固体沉降,再将上层溶液倾倒入另一容器。
根据以上流程回答下列问题:
(1)废渣A的主要成分是__________________ (填化学式)。
(2)PbSO4在热的NaCl浓溶液中溶解生成PbCl42-,则①中反应的离子方程式为_______ ;加入CaCl2的目的是________________ 。
(3)“滤液B→PbOHCl”的离子方程式为_________________ 。
(4)已知NaOH浓溶液有强烈的腐蚀性,会腐蚀滤纸。所以,从粗产品悬浊液提取最终产品的操作X依序是(填操作名称)__________ 、___________ 、过滤、干燥。
(5)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%的乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA(用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,计算产品中PbO的纯度为_______ (保留三位有效数字)。(已知:Pb2++H2Y=PbY+2H+)
已知:从液体中分离出密度较大且不溶的固体常用倾析法,即先使固体沉降,再将上层溶液倾倒入另一容器。
根据以上流程回答下列问题:
(1)废渣A的主要成分是
(2)PbSO4在热的NaCl浓溶液中溶解生成PbCl42-,则①中反应的离子方程式为
(3)“滤液B→PbOHCl”的离子方程式为
(4)已知NaOH浓溶液有强烈的腐蚀性,会腐蚀滤纸。所以,从粗产品悬浊液提取最终产品的操作X依序是(填操作名称)
(5)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%的乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA(用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,计算产品中PbO的纯度为
您最近一年使用:0次
2017-03-16更新
|
163次组卷
|
3卷引用:2017届广西桂林市、崇左市高三联合调研考试理科综合化学试卷
2017届广西桂林市、崇左市高三联合调研考试理科综合化学试卷(已下线)广西桂林市、崇左市2017届高三联合调研考试理科综合化学试题安徽省滁州市定远县育才学校2022届高三5月教学质量检测理科综合化学试题
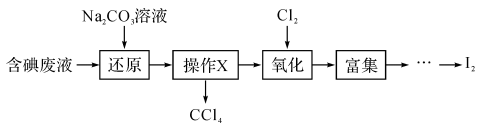
7 . 实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘和CCl4,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
______________ ;该操作将I2还原为I-的主要目的是 ____________ 。
(2)操作X的名称为___ 。
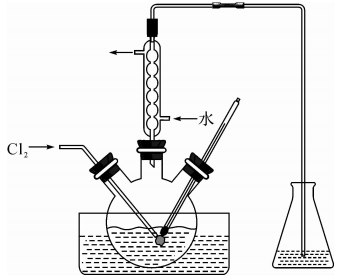
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_____________ ;锥形瓶里盛放的溶液为_______________
(4)在教材碘水的萃取实验中,最后要从碘的CCl4溶液中回收利用CCl4,可以采用下列方法:先水浴加热蒸馏碘的CCl4溶液,收集得到浅红色的液体。再向该液体中加入少量块状的活性炭,静置。待溶液的浅红色消失。操作Y,即可得无色透明的CCl4液体。
①收集得到浅红色的液体说明,收集得到的液体中含有___ (化学式),②加入少量活性炭的目的是 ______ ,③操作Y的名称是 ___ 。
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
(2)操作X的名称为
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是
(4)在教材碘水的萃取实验中,最后要从碘的CCl4溶液中回收利用CCl4,可以采用下列方法:先水浴加热蒸馏碘的CCl4溶液,收集得到浅红色的液体。再向该液体中加入少量块状的活性炭,静置。待溶液的浅红色消失。操作Y,即可得无色透明的CCl4液体。
①收集得到浅红色的液体说明,收集得到的液体中含有
您最近一年使用:0次
2017-03-04更新
|
322次组卷
|
2卷引用:广西名校2017届高三高考模拟考试押题卷理综化学试题



