解题方法
1 . 用含钴废料(主要成分为Co,还含有一定量的NiO,Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC 2O4·2H 2O)的工艺流程如下图所示:

已知:①草酸钴晶体难溶于水;②RH为有机物(难电离)。回答下列问题:
(1)滤渣I的主要成分是_______ (填化学式),操作①的名称_______ ,需用到的玻璃仪器有_______ 。
(2)H2O2是一种绿色氧化剂,加入H2O2时发生反应的离子方程式为_______ 。加入CoO的目的是_______ 。
(3)[已知:溶液中某种离子的浓度小于1.0×10-5mol·L,则认为该离子已经完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1.0×10-15、1.0×10-38、1.0×10-32]。若要将浸出液中Fe3+和Al3+全部沉淀,则应将浸出液的pH控制在_______ 之间。
(4)加入有机溶剂的目的是_______ 。实验室可以用酸性KMnO4标准液滴定溶液中的C2O 浓度,KMnO4标准液常用硫酸酸化,若用盐酸酸化,会使测定结果
浓度,KMnO4标准液常用硫酸酸化,若用盐酸酸化,会使测定结果_______ (填“偏高”、“偏低”或“无影响”)。
(5)水层中加入(NH4)2C2O4溶液,判断Co2+沉淀完全的操作是_______ 。

已知:①草酸钴晶体难溶于水;②RH为有机物(难电离)。回答下列问题:
(1)滤渣I的主要成分是
(2)H2O2是一种绿色氧化剂,加入H2O2时发生反应的离子方程式为
(3)[已知:溶液中某种离子的浓度小于1.0×10-5mol·L,则认为该离子已经完全沉淀;Ni(OH)2、Fe(OH)3、Al(OH)3的Ksp分别为1.0×10-15、1.0×10-38、1.0×10-32]。若要将浸出液中Fe3+和Al3+全部沉淀,则应将浸出液的pH控制在
(4)加入有机溶剂的目的是
 浓度,KMnO4标准液常用硫酸酸化,若用盐酸酸化,会使测定结果
浓度,KMnO4标准液常用硫酸酸化,若用盐酸酸化,会使测定结果(5)水层中加入(NH4)2C2O4溶液,判断Co2+沉淀完全的操作是
您最近一年使用:0次
解题方法
2 . 三氧化二铋(Bi2O3)是黄色不溶于水的固体,俗称铋黄,可用于制作黄色颜料、耐火纸等。利用含铋废料(还含Cu、Pb、Zn的硫酸盐及CuS、Fe2O3)制备Bi2O3流程如下:
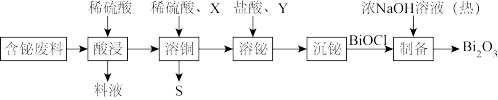
(1)“酸浸”后的固体中除含铋的化合物、CuS外,还含有___________ ;料液中含有多种成分,向料液中加入过量锌粉并充分搅拌,过滤后,滤液经过___________ 冷却结晶、过滤、洗涤、干燥即可制得ZnSO4·7H2O。
(2)“溶铜”时,试剂X可以是多种物质,分别使用O2、H2O2、MnO2三种氧化剂,氧化等物质的量同一种还原剂时,且得到相同氧化产物,消耗这三种氧化剂物质的量之比为___________ (MnO2转化为Mn2+);写出X为O2时,“溶铜”CuS反应的离子方程式:___________ 。
(3)其他条件相同时,溶液中c(Cl-)越大,铋的溶出率越大,仅从原料成本角度考虑,试剂Y是___________ 。
(4)写出“制备”步骤生成铋黄的离子方程式:___________ 。

(1)“酸浸”后的固体中除含铋的化合物、CuS外,还含有
(2)“溶铜”时,试剂X可以是多种物质,分别使用O2、H2O2、MnO2三种氧化剂,氧化等物质的量同一种还原剂时,且得到相同氧化产物,消耗这三种氧化剂物质的量之比为
(3)其他条件相同时,溶液中c(Cl-)越大,铋的溶出率越大,仅从原料成本角度考虑,试剂Y是
(4)写出“制备”步骤生成铋黄的离子方程式:
您最近一年使用:0次
3 . 一种从含铅废渣(主要成分为PbSO4,还含有少量CuO、FeO等)中制取电解铅的工艺流程如下:
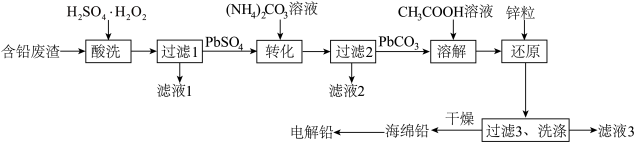
回答下列问题:
(1)“滤液1”中溶质的主要成分有_________ 。
(2)“转化”时发生PbSO4+ =PbCO3+
=PbCO3+ ,为提高PbSO4的转化率可采取的适宜措施是
,为提高PbSO4的转化率可采取的适宜措施是________ (写出两点);“滤液2”中主要溶质是______ (填化学式)。
(3)“溶解”时发生反应的化学方程式为_________ 。
(4)“还原”时,控制溶液pH约为5~6。pH不宜过低,其原因是__________ ;还原过程中需不断搅拌,不断搅拌的主要目的是_____________ 。
(5)海绵铅(主要成分为铅,还含有少量Fe、Cu、Sn等杂质)用PbSiF6和H2SiF6的混合溶液作电解质进行电解,阳极泥的主要成分为________ ;阴极的电极反应式为______ 。

回答下列问题:
(1)“滤液1”中溶质的主要成分有
(2)“转化”时发生PbSO4+
 =PbCO3+
=PbCO3+ ,为提高PbSO4的转化率可采取的适宜措施是
,为提高PbSO4的转化率可采取的适宜措施是(3)“溶解”时发生反应的化学方程式为
(4)“还原”时,控制溶液pH约为5~6。pH不宜过低,其原因是
(5)海绵铅(主要成分为铅,还含有少量Fe、Cu、Sn等杂质)用PbSiF6和H2SiF6的混合溶液作电解质进行电解,阳极泥的主要成分为
您最近一年使用:0次
4 . 钼酸钠晶体(Na2MoO4·2H2O)常用于配制金属缓蚀剂。下图是利用钼精矿(主要成分是MoS2含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。

回答下列问题:
(1)Na2MoO4·2H2O中钼元素的化合价是________ ;
(2)“焙烧”反应为2MoS2+7O2 2MoO3+4SO2,该反应氧化产物是
2MoO3+4SO2,该反应氧化产物是_______ (填化学式),写出一条提高焙烧效率的措施_______________ 。
(3)“浸取”时含钼化合物发生反应的离子方程式为______________ 。
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO 。若滤液中(MoO
。若滤液中(MoO )=0.40mol/L,c(CO
)=0.40mol/L,c(CO )=0.20mol/L,要使钼元素无损失,残余CO
)=0.20mol/L,要使钼元素无损失,残余CO 的最低浓度是
的最低浓度是___ mol/L[已知:Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8;
(5)将粗品进一步提纯的操作名称是__________ 。
(6)钼酸钠也可用钼酸铵[(NH4)2MoO4]和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为_________ 。
(7)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。
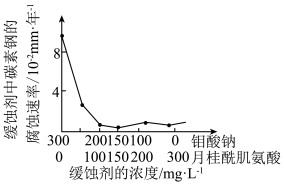
要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为___ mol/L。

回答下列问题:
(1)Na2MoO4·2H2O中钼元素的化合价是
(2)“焙烧”反应为2MoS2+7O2
 2MoO3+4SO2,该反应氧化产物是
2MoO3+4SO2,该反应氧化产物是(3)“浸取”时含钼化合物发生反应的离子方程式为
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO
 。若滤液中(MoO
。若滤液中(MoO )=0.40mol/L,c(CO
)=0.40mol/L,c(CO )=0.20mol/L,要使钼元素无损失,残余CO
)=0.20mol/L,要使钼元素无损失,残余CO 的最低浓度是
的最低浓度是(5)将粗品进一步提纯的操作名称是
(6)钼酸钠也可用钼酸铵[(NH4)2MoO4]和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为
(7)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。

要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为
您最近一年使用:0次
5 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图:
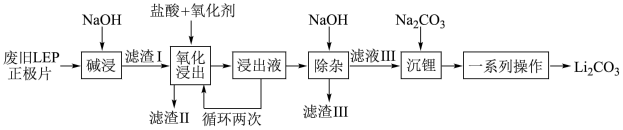
已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是_______ (填标号)。
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是______ 。在“氧化浸出”时,温度不宜超过50℃,其目的是________ 。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为_________ 。
(3)“浸出液”循环两次的目的是________ 。
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为________ 。“一系列操作”具体包括______ 、洗涤、干燥。
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为_________ 。

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是
| 序号 | 锂含量/% | 氧化剂 | pH | 浸出液体Li浓度/(g·L-1) | 浸出渣中Li含量/% |
| 1 | 3.7 | H2O2 | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 | NaClO3 | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 | O2 | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 | NaClO | 3.5 | 8.24 | 0.43 |
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为
您最近一年使用:0次
2020-11-02更新
|
509次组卷
|
3卷引用:广西梧州市2021届高三3月联考理科综合化学试题
6 . 用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下:

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的PH

(1)H2SO4溶解Al2O3的离子方程式是____________ 。
(2)检验滤液中还存在Fe2+的方法是______________ 。
(3)“除杂”环节有如下几个步骤:(I)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2 (II)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤I 的目的是:_________ ;调节溶液的pH为3.2的目的是__________ 。
②向步骤II的沉淀中加入浓HCl并加热,有黄绿色气体生成,写出其反应方程式______ 。
③步骤Ⅲ中加入MnSO4的目的是__________ (用离子反应方程式表示)
(4)从多次循环使用后母液中可回收的主要物质是________ (填化学式)。

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的PH

(1)H2SO4溶解Al2O3的离子方程式是
(2)检验滤液中还存在Fe2+的方法是
(3)“除杂”环节有如下几个步骤:(I)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2 (II)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤I 的目的是:
②向步骤II的沉淀中加入浓HCl并加热,有黄绿色气体生成,写出其反应方程式
③步骤Ⅲ中加入MnSO4的目的是
(4)从多次循环使用后母液中可回收的主要物质是
您最近一年使用:0次
2020-10-18更新
|
736次组卷
|
2卷引用:2017届广西柳州市高三10月模拟理综化学试卷
名校
解题方法
7 . 铬铁矿的成分主要为 FeCr2O4,另含有少量 Al2O3和 SiO2。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:

已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4和 NaFeO2等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为_________________ ;
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO 转化为 Cr2O
转化为 Cr2O ,离子方程式为
,离子方程式为 __________________ ;二是______________ 。
(3) “煅烧”铬铁矿时,主要成分反应的化学方程式为_____________________ 。
(4) 根据下图溶解度(S)~温度(T) 曲线判断,

对滤液②进行的最佳“分离”方法为________ ( 填序号 ) 。
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为____________________________ 。
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为________ 。

已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4和 NaFeO2等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO
 转化为 Cr2O
转化为 Cr2O ,离子方程式为
,离子方程式为 (3) “煅烧”铬铁矿时,主要成分反应的化学方程式为
(4) 根据下图溶解度(S)~温度(T) 曲线判断,

对滤液②进行的最佳“分离”方法为
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为
您最近一年使用:0次
2020-07-03更新
|
226次组卷
|
2卷引用:广西桂林市第十八中学2020届高三考前适应性考试化学试题
8 . 一种利用钛铁矿制备Li4Ti5O12的工艺流程如图:
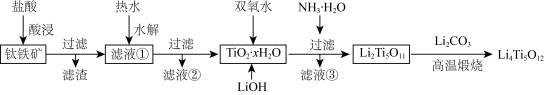
已知:钛铁矿的主要成分是FeTiO3(可表示为FeO·TiO2),还含有少量的MgO和SiO2等杂质。
回答下列问题:
(1)酸浸时,要提高铁的浸出率可采取的措施是___ (写出一条即可)。
(2)酸浸后的滤液①中钛主要以TiOCl42-形式存在,则其水解生成TiO2·xH2O的离子方程式为___ ,加热水的目的是___ 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应时,应将温度控制在50℃左右的原因是___ 。
(4)若将滤液②加热至一定温度后,再加入双氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],此时溶液中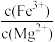 =
=___ 。已知:此温度下,FePO4、Mg3(PO4)2的溶度积常数分别为1.5×10-21、1.0×10-23。
(5)高温煅烧时发生反应的化学反应方程式为___ 。
(6)某可充电的锂离子电池以Li4Ti5O12为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,则充电时阴极电极反应式为___ 。

已知:钛铁矿的主要成分是FeTiO3(可表示为FeO·TiO2),还含有少量的MgO和SiO2等杂质。
回答下列问题:
(1)酸浸时,要提高铁的浸出率可采取的措施是
(2)酸浸后的滤液①中钛主要以TiOCl42-形式存在,则其水解生成TiO2·xH2O的离子方程式为
(3)TiO2·xH2O沉淀与双氧水、氨水反应时,应将温度控制在50℃左右的原因是
(4)若将滤液②加热至一定温度后,再加入双氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],此时溶液中
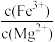 =
=(5)高温煅烧时发生反应的化学反应方程式为
(6)某可充电的锂离子电池以Li4Ti5O12为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,则充电时阴极电极反应式为
您最近一年使用:0次
解题方法
9 . 实验室以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O},其流程如下:
V2O5 VOCl2溶液
VOCl2溶液 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
(1)“还原”过程中的还原剂是____________ (填化学式)。
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。
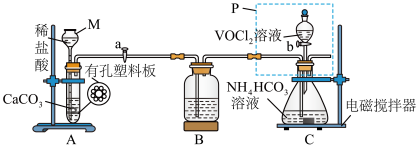
①仪器M的名称是___________ ,实验开始前的操作是_________ 。
②装置B的作用是__________________ 。
③加完VOCl2溶液后继续搅拌一段时间,使反应完全,再进行下列操作,顺序为_______ (填字母)。
a.锥形瓶口塞上橡胶塞
b.取下P
c.将锥形瓶置于干燥器中,静置过夜
④得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是_______ (填离子符号),用无水乙醇洗涤的目的是_______________ 。
⑤称量 产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为
产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为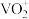 +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为V mL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为V mL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______________ (填“偏高”“偏低”或“无影响”),产品中钒的质量分数为_________ (以VO2+的量进行计算,列出计算式)。
V2O5
 VOCl2溶液
VOCl2溶液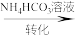 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体(1)“还原”过程中的还原剂是
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。

①仪器M的名称是
②装置B的作用是
③加完VOCl2溶液后继续搅拌一段时间,使反应完全,再进行下列操作,顺序为
a.锥形瓶口塞上橡胶塞
b.取下P
c.将锥形瓶置于干燥器中,静置过夜
④得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是
⑤称量
 产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为
产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol/L KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为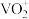 +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为V mL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为V mL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果
您最近一年使用:0次
2020-06-09更新
|
395次组卷
|
4卷引用:广西钦州市2020届高三5月质量检测理科综合化学试题
广西钦州市2020届高三5月质量检测理科综合化学试题河北省2020年5月“五个一”名校(邯郸一中石家庄一中张家口一中保定一中唐山一中)联盟高三联考化学试题广西壮族自治区玉林市柳州市贵港市百色市2020届高三下学期5月质量检测考试理科综合化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编
解题方法
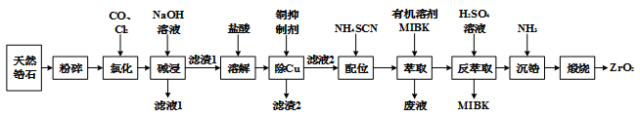
10 . 一种类似钻石的装饰品——锆石(ZrSiO4),其做为装饰品,价格低廉,外观璀璨。天然锆石中常含有Fe、Al、Cu的氧化物杂质,称为锆英石。工业上一种以锆英石为原料制备ZrO2的工艺流程如下:
Ⅰ. Zr在化合物中通常显 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:______________
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为______________
②ZrCl4产率随温度、压强的变化如图所示,回答问题

“氯化”过程选择的最佳条件为_______ ;“氯化”环节产率随温度升高先增大后减小的原因为______
(3)“滤液1”中含有的阴离子,除OH-外还有____________________
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为_____________ (假设溶液混合后体积可以相加,计算结果保留两位小数)
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为_____________

Ⅰ. Zr在化合物中通常显
 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为
②ZrCl4产率随温度、压强的变化如图所示,回答问题

“氯化”过程选择的最佳条件为
(3)“滤液1”中含有的阴离子,除OH-外还有
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为
您最近一年使用:0次



